题目内容
【题目】汽车尾气中含有CO、NO等有害气体。
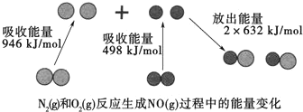
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会________(填“吸收”或“放出”)________kJ能量。
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.2×10-3 | b | 124 |
Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请将表中数据补充完整:a___________。
②能验证温度对化学反应速率规律的是实验____________________(填实验序号)。
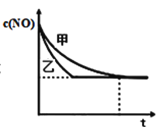
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线________________(填“甲”或“乙”)。
④在容积固定的容器中发生反应2NO+2CO![]() 2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内CO浓度不变 B.容器内NO的浓度等于CO2的浓度
C.v逆(NO)=2v正(N2) D.容器内混合气体密度保持不变
【答案】吸收 180 1.2×10-3 Ⅰ和Ⅲ 乙 BD
【解析】
由图中能量的变化,根据反应热=反应物断键吸收的能量-生成物成键释放出的能量的计算结果进行解答,利用控制变量的实验方法,验证温度、催化剂的比表面积对化学反应速率的影响,其他条件相同时,催化剂可以加快反应的速率,可逆反应达到平衡的标志就是变量不变了。
(1)由图知反应为N2(g)+O2(g)=2NO(g),反应热=反应物断键吸收的能量-生成物成键释放出的能量,该反应的反应热=(946+498)kJ/mol-2632kJ/mol=+180kJ/mol,所以这是一个吸热反应,1molN2和1molO2完全反应生成NO会吸收180kJ的能量,答案为:吸收;180;
(2)①要验证温度对化学反应速率的影响,温度要不同,其他条件要相同,观察表中三个实验中的数据可知a=1.210-3,答案为:1.210-3;
②验证温度对化学反应的影响,只有实验I、III的温度不同,其他条件相同,故答案为:Ⅰ和Ⅲ;
③催化剂比表面积越大,反应速率越快,到达平衡的时间越短,实验II中催化剂的比表面积大,反应速率快,由图可知,曲线乙的斜率大,反应快,答案为:乙;
④在容积固定的容器中发生反应2NO+2CO ![]() 2CO2+N2:
2CO2+N2:
A.没有达到平衡之前,CO的浓度一直在减小,容器内CO浓度不变则说明反应达到平衡,A不符题意;
B.反应过程中NO的浓度在不断减少,CO2的浓度不断增加,二者浓度相等,与是否达到平衡无关,B符合题意;
C.v逆(NO)=2v正(N2),速率之比等于化学计量数之比,说明正逆反应速率相等,反应达到平衡状态,C不符题意;
D.由质量守恒定律可知,反应前后气体质量不变,容器的体积不变,则容器内混合气体的密度一直保持不变,故混合气体的密度不变不能说明反应已达到平衡状态,D符合题意,答案为BD。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)②的原子结构示意图是___________。
(2)化学性质最不活泼的元素是___________(填元素符号)。
(3)③和④原子中,原子半径较大的是___________(填元素符号)。
(4)常用作半导体材料的是___________(填名称)。
(5)⑧、⑨的最高价氧化物对应的水化物中酸性较强的是_________(填化学式)。
(6)焰色反应显黄色的物质所含的金属元素是___________(填元素符号)。
(7)元素最高价氧化物对应的水化物中,呈两性的是___________(填化学式)。
(8)结构简式为![]() 的有机物分子式是_____,其中碳元素与氢元素的质量比m(C)∶(H)=________。
的有机物分子式是_____,其中碳元素与氢元素的质量比m(C)∶(H)=________。
【题目】丙酮的碘代反应![]() 的速率方程为
的速率方程为![]() ,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为
,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为![]() 改变反应物浓度时,反应的瞬时速率如表所示。
改变反应物浓度时,反应的瞬时速率如表所示。
|
|
|
0.25 | 0.050 | 1.4 |
0.50 | 0.050 | 2.8 |
1.00 | 0.050 | 5.6 |
0.50 | 0.100 | 2.8 |
下列说法正确的是( )
A.速率方程中的![]() 、
、![]()
B.该反应的速率常数![]()
C.增大![]() 的浓度,反应的瞬时速率加快
的浓度,反应的瞬时速率加快
D.在过量的![]() 存在时,反应掉87.5%的
存在时,反应掉87.5%的![]() 所需的时间是375min
所需的时间是375min