��Ŀ����
����Ŀ�����и������ʼ䷴Ӧ���ܰ����ಽ��Ӧ�����ܵ����ӷ���ʽ��ȷ���ǣ� ��
A.������������ʵ���Ũ�ȵ�������Һ��Ba��OH��2��Һ��ϣ�3Ba2++6OH��+2Al3++3SO ![]() �T2Al��OH��3��+3BaSO4��
�T2Al��OH��3��+3BaSO4��
B.FeCl2�ڿ����б�������4Fe2++O2+2H2O�T4Fe3++4OH��
C.AlCl3��aq����Ͷ�����Na��2Al3++6Na+6H2O�T2Al��OH��3��+6Na++3H2��
D.4molFeBr2��aq�� ��ͨ��3molCl2��2Fe2++4Br��+3Cl2�T2Fe3++2 Br2+6Cl��
���𰸡�A
���������⣺A�������ʵ���Ba��OH��2��������Ӧ�������ᱵ���������������ӷ���ʽΪ��3Ba2++6OH��+2Al3++3SO ![]() �T2Al��OH��3��+3BaSO4������A��ȷ�� B��FeCl2�ڿ����б����������ӷ���ʽΪ��12Fe2++302+6H2O=8Fe3++4Fe��OH��3������B����
�T2Al��OH��3��+3BaSO4������A��ȷ�� B��FeCl2�ڿ����б����������ӷ���ʽΪ��12Fe2++302+6H2O=8Fe3++4Fe��OH��3������B����
C��AlCl3��aq����Ͷ�����Na�����ӷ���ʽΪ��Al3++4Na+2H2O�TAlO ![]() +4Na++2H2������C����
+4Na++2H2������C����
D.4molFeBr2 ��aq�� ��ͨ��3molCl2 �� ���ӷ���ʽΪ��4Fe2++2Br��+3Cl2=4Fe3++Br2+6Cl�� �� ��D����
��ѡ��A��

 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д� ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д� �ƸԿ�����ҵ��ϵ�д�
�ƸԿ�����ҵ��ϵ�д�����Ŀ����֪CaSO4���ȷֽ⣬���������¶Ȳ�ͬ������ɷ�Ҳ��ͬ������ɷֿ���ΪSO2��SO3��O2�е�һ�֡����ֻ����֣�ij��ѧ����С����ͨ��ϵ��ʵ��̽��CaSO4�ֽ����ɵ����壬����ȷ��CaSO4�ֽ�Ļ�ѧ����ʽ��
��1��[�������]����������ijɷֿ���ֻ��SO3һ�֣�
����������ijɷֿ��ܺ������֣��������ʽ��
��2������������ijɷֿ��ܺ��� SO2��SO3��O2���֣�[���ʵ��]
�û�ѧ����С����ͨ���ⶨDװ�õ������Լ���Ͳ��ˮ���������̽��CaSO4�ֽ����ɵ�����ɷ֣�����ȷ��CaSO4�ֽ�Ļ�ѧ����ʽ��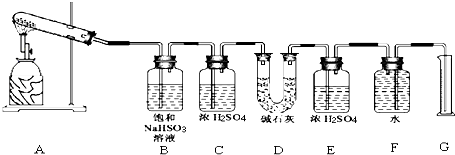
[ʵ�����]
��������ʵ�鷽���������飮��֪ʵ�����ʱ��CaSO4��ȫ�ֽ⣮
��������ʵ������ͼ�¼��ʵ�����ݽ��з�����
����ʵ�����ʱ��G����Ͳû���ռ���ˮ����֤��������ȷ�����������
����ʵ�����ʱ��װ��D�����������ӣ��ܷ�϶����������һ������SO2������SO3����˵�����ɣ� ��
�۸�ʵ������У������ⶨ�����ϴ����������� ��
��д��һ�ּ��ɣ�
�ܾ��Ľ���������ͬѧ���и�ʵ�飬���ڼ���ʱ���¶Ȳ�ͬ��ʵ��������Ҳ��ͬ��
����������£�
ʵ��С�� | ��ȡCaSO4 | װ��D���� | ��ȡ���������װ�ò������������ ������ɱ�״�������������� ��mL�� |
һ | 4.08 | 2.56 | 224 |
�� | 5.44 | 2.56 | 448 |
��ͨ�����㣬�ƶϵڶ���ͬѧ�ó���CaSO4�ֽ�Ļ�ѧ��Ӧ����ʽ��
�ڶ��飺 ��