题目内容
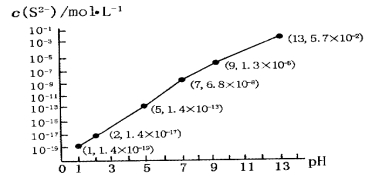
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。

根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为 ,正反应为________(填“吸热”或“放热”)反应。
(2)在密闭容器中,加入2 mol A和6 mol B。
① 当反应达到平衡时, A和B的浓度比是_______;A和B的转化率之比是_______。
② 升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
③ 当达到平衡时,充入氩气,并保持压强不变,平衡将____(填“正向”、“逆向”或“不”)移动。
【答案】(1) A(g)+3B(g) ![]() 2C(g) (若写为“=”该题不得分) 放热
2C(g) (若写为“=”该题不得分) 放热
(2)① 1∶3 1∶1 ② 变小 ③ 逆向
【解析】
试题分析:(1)根据图1可知A、B的浓度减少,为反应物,C的浓度增加,C是生成物。平衡时A、B减少的浓度分别是0.2mol/L、0.6mol/L,C增加0.4mol/L,所以根据浓度的变化量之比是相应的化学计量数之比可知A与B反应生成C的化学方程式为A(g)+3B(g) ![]() 2C(g);根据图2可知T1时首先达到平衡状态,但B的体积分数大于T2时的体积分数,这说明升高温度平衡逆反应方向进行,因此正反应为放热反应。
2C(g);根据图2可知T1时首先达到平衡状态,但B的体积分数大于T2时的体积分数,这说明升高温度平衡逆反应方向进行,因此正反应为放热反应。
(2)①由于A和B是按照化学计量数之比充入反应,因此当反应达到平衡时, A和B的浓度比始终是1∶3,而A和B的转化率之比是1∶1。
②正反应放热,升高平衡体系的温度(保持体积不变),平衡向逆反应方向进行,气体的物质的量增加,但质量不变,因此混合气体的平均相对分子质量变小。
③当达到平衡时,充入氩气,并保持压强不变,则容器的容积必然增大,因此平衡将逆向移动。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案