题目内容
【题目】下表是元素周期表中的一部分元素,用元素符号或化学式回答下列问题:
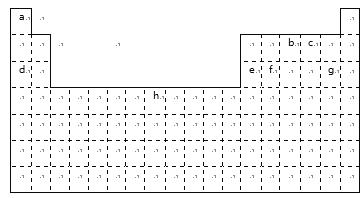
(1)h元素在周期表中的位置是_______;
(2)表中所列元素中,金属性最强的是____;元素最高价含氧酸酸性最强的是____;(填化学式)
(3)c、d、e、g中,离子半径最小的是____;(填离子符号)
(4)a和b化合时形成_____键;a和d化合时形成______键;
(5)由a、c、d形成的化合物的电子式为__________。
【答案】第四周期,第Ⅷ族 Na HClO4 Al3+ 共价 离子 ![]()
【解析】
由元素在周期表中的位置可知,a为H元素、b为N元素、c为O元素、d为Na元素、e为Al元素、f为Si元素、g为Cl元素、h为Fe元素,据此分析解答。
由元素在周期表中的位置可知,a为H元素、b为N元素、c为N元素、d为Na元素、e为Al元素、f为Si元素、g为Cl元素、h为Fe元素。
(1)h为Fe元素,在周期表中的位置是第四周期,第Ⅷ族;
(2)同周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强;同主族从上到下,金属性逐渐增强,非金属性逐渐减弱;表中所列元素中,金属性最强的元素应在表的左下角,是Na;元素的非金属性越强,最高价氧化物的水化物的酸性越强,但F元素无最高价氧化物的水化物,故以上元素中,最高价氧化物对应水化物酸性最强的是HClO4;
(3)具有相同电子层结构的离子核电荷数越大,离子半径越小,故离子半径O2->Na+>Al3+,比其他离子多一个电子层,半径最大,故c、d、e、g中离子半径Cl->O2->Na+>Al3+,离子半径最小的是Al3+;
(4)a和b化合时生成NH3,形成共价键;a和d化合时生成NaH,形成离子键;
(5)由a、c、d形成的化合物NaOH的电子式为![]() 。
。

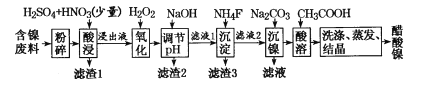
【题目】Ni为第Ⅷ 族元素,在许多工业生产中都有涉及。
已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

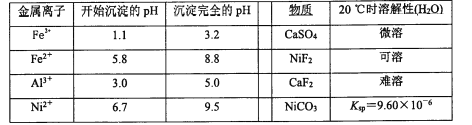
已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10 ③当某物质浓度小于1.0×10-5 mol/L时,视为完全沉淀
(1)请写出一种能提高酸浸速率的措施________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式__________________________。
(3)pH的调控范围为 __________________,滤渣Ⅱ的成分为_____________________________。
(4)写出“沉镍”时反应的离子方程式___________________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________________,当Ca2+沉淀完全时,溶液中c(F-)>_____________ mol/L(写出计算式即可)。
(5)操作a的内容是____________________________________________。