题目内容
20.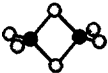 硼的最简单氢化物--乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH+B2H6=2LiBH4
硼的最简单氢化物--乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH+B2H6=2LiBH4(1)乙硼烷分子中硼原子的杂化轨道类型为sp3.
(2)BH4-为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为DE (填序号).
A.离子键 B.金属键 C.氢键 D.配位键 E.极性键F.非极性键.
分析 (1)根据价层电子对互斥理论确定其杂化类型;
(2)B原子含有空轨道,H原子含有孤电子对,所以二者能形成配位键,B原子和H原子之间还存在极性共价键.
解答 解:(1)乙硼烷分子中每个硼原子含有4个共价键,所以B原子的价层电子对数为4,采用sp3杂化,
故答案为:sp3;
(2)乙硼烷中B原子含有空轨道,一个H原子含有孤电子对,所以能形成配位键,B原子和H原子还能形成极性共价键,
故选:DE.
点评 本题考查了杂化理论的应用和化学键,题目难度不大,注意把握价层电子对互斥理论及应用方法.

练习册系列答案
相关题目
10.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 已知Ksp(MnS)>Ksp(CdS) 所以工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+离子 | |
| B. | 采用加热方法消毒的目的是使蛋白质变性而杀灭细菌 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化 |
11.鼠尾草酚用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( )

| A. | X、Y、Z属于芳香族化合物 | |
| B. | X、Y、Z均能与FeCl3溶液发生显色反应 | |
| C. | 1 mol X或1mol Z与NaOH溶液反应,均最多消耗3molNaOH | |
| D. | X、Y、Z均能与溴的四氯化碳溶液发生加成反应 |
8.下列叙述中错误的是( )
| A. | 用水可以鉴别乙醇、苯、和溴苯 | |
| B. | 甲苯与氯气在光照下可发生取代反应,主要生成2,4-二氯甲苯 | |
| C. | 化学式为C7H16的有机物,分子中含有3个甲基的可能结构有3种 | |
| D. | 乙酸丁酯中含乙酸杂质,可以加入饱和碳酸钠溶液洗涤,然后通过分液来去除杂质 |
15.图象能直观地反映有关物理量的变化及规律,下列各图象与描述相符的是( )
| A. | 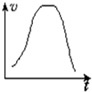 此图表示一定条件下某化学反应速率随时间变化趋势图,该反应不可能为吸热反应 | |
| B. | 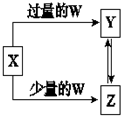 此图中X可以是H2S,W可以是O2 | |
| C. | 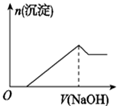 此图表示向AlCl3、MgCl2的混合液中逐滴滴入NaOH至过量 | |
| D. | 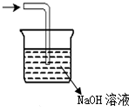 此图可以用来直接处理像H2S、Cl2、NO等尾气 |
5.下列有关物质性质的说法错误的是( )
| A. | 热稳定性:HCl>H2S | B. | 原子半径:N>O | ||
| C. | 结合质子能力:S2->Cl- | D. | 酸性:H2SO3>H2SO4 |
12.下列有关生活中的化学,说法不正确的是( )
| A. | 石油裂解、煤的气化、海水制镁都包含化学变化 | |
| B. | 福尔马林用于制备标本是利用了其使蛋白质变性的性质 | |
| C. | 红葡萄酒储藏时间长后变香可能是因为乙醇发生了酯化反应 | |
| D. | 含钙、钡、铁等金属元素的物质有绚丽的颜色,可用于制造焰火 |
14.下列说法正确的是( )
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 某有机化合物完全燃烧生成等物质的量的CO2和H2O,则该有机物的分子式一定CnH2n | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| D. | HOCH2COOH既可发生取代反应,也可发生加聚反应 |