题目内容
【题目】(1)质量之比为16∶7∶6的三种气体SO2、CO、NO,分子个数之比为________;氧原子个数之比为________;相同条件下体积比为________。
(2)某气体氧化物的化学式为RO2,在标准状况下,0.92g该氧化物的体积为448ml,则该氧化物的摩尔质量为________,R的相对原子质量为________。RO2的化学式为_____________
(3)常温下,在27.5g水中溶解12.5gCuSO4·5H2O,恰好达到饱和,该溶液的密度为1.21 g/cm3,则该溶液中CuSO4的物质的量浓度_________________,从中取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是_____________ml。
【答案】
(1)5:5:4;10:5:4 5:5:4
(2)46g/mol;14;NO2;
(3)1.51mol/L;30.2mL。
【解析】
试题分析:(1)质量比为16:7:6的三种气体 SO2、CO、NO物质的量之比为![]() :
:![]() :
:![]() =5:4:4,故三者分子数目之比为5:4:4,含有氧原子数目之比为5×2:5×1:4×1=10:5:4,相同条件下,气体体积之比等于其物质的量之比,则三者体积之比为5:4:4,故答案为:5:5:4;10:5:4;5:5:4;
=5:4:4,故三者分子数目之比为5:4:4,含有氧原子数目之比为5×2:5×1:4×1=10:5:4,相同条件下,气体体积之比等于其物质的量之比,则三者体积之比为5:4:4,故答案为:5:5:4;10:5:4;5:5:4;
(2)RO2的物质的量的物质的量为![]() =0.02mol,其摩尔质量为
=0.02mol,其摩尔质量为![]() =46g/mol,R的相对原子质量为46-32=14,R为N元素,RO2的化学式为NO2,故答案为:46g/mol;14;NO2;
=46g/mol,R的相对原子质量为46-32=14,R为N元素,RO2的化学式为NO2,故答案为:46g/mol;14;NO2;
(3)12.5g CuSO45H2O的物质的量为![]() =0.05mol,则溶液中硫酸铜的物质的量为0.05mol,溶液的体积为
=0.05mol,则溶液中硫酸铜的物质的量为0.05mol,溶液的体积为![]() =
=![]() mL,故硫酸铜溶液的物质的量浓度为
mL,故硫酸铜溶液的物质的量浓度为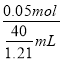 =1.51mol/L,根据稀释定律,稀释前后溶质的物质的量不变,则20.0ml该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积为
=1.51mol/L,根据稀释定律,稀释前后溶质的物质的量不变,则20.0ml该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积为![]() =30.2mL,故答案为: 1.51mol/L;30.2mL。
=30.2mL,故答案为: 1.51mol/L;30.2mL。