题目内容
【题目】2NO2![]() N2O4正反应放热,把烧瓶置于100℃沸水中,下列哪几项性质不会改变( )
N2O4正反应放热,把烧瓶置于100℃沸水中,下列哪几项性质不会改变( )
①颜色②平均相对分子质量③质量④压强
A.①③B.②④C.④D.③
【答案】D
【解析】
2NO2![]() N2O4正反应放热,把烧瓶置于100℃沸水中,温度升高,化学平衡逆向移动。
N2O4正反应放热,把烧瓶置于100℃沸水中,温度升高,化学平衡逆向移动。
①NO2为红棕色气体,N2O4为无色气体,升高温度,平衡逆向移动,NO2浓度增大,颜色加深;
②升高温度,平衡逆向移动,混合气体总的物质的量增大,混合气体总质量不变,根据M=m/n可知,混合气体的平均相对分子质量减小;
③NO2、N2O4均为气体,根据质量守恒定律,混合气体总质量不变;
④升高温度,平衡逆向移动,混合气体总的物质的量增大、混合气体的温度升高,容器的容积不变,根据pV=nRT可知,容器内压强增大;
只有③不变,故答案为:D。

练习册系列答案
相关题目
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
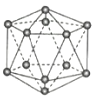
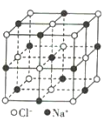
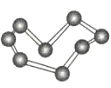
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键