题目内容
【题目】下列说法正确的是( )
A. 1mol·L-1AlCl3溶液中,含Al3+数目小于NA
B. 标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA
C. 25℃,1LpH=1的稀硫酸中含有的H+数为0.2NA
D. 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COOˉ数目为NA个
【答案】D
【解析】A项,没告诉AlCl3溶液的体积,无法计算Al3+数目,故A错误;B项,n(NO)=6.0g÷30g/mol=0.2mol,n(O2)=2.24L÷22.4L/mol=0.1mol,发生反应:2NO+O2=2NO2,2NO2![]() N2O4,所以所得气体分子数应小于0.2NA,故B错误;C项,因为pH=lg[H+],所以25℃,1L pH=1的稀硫酸中含有的H+数为0.1NA,故C错误;D项,由电荷守恒可得:[H+]+[Na+]=[OH-]+[CH3COO-],又因为溶液呈中性,所以[H+]=[OH-],[Na+]=[CH3COO-],因此CH3COOˉ数目等于Na+数目,为NA个,故D正确。综上,选D。
N2O4,所以所得气体分子数应小于0.2NA,故B错误;C项,因为pH=lg[H+],所以25℃,1L pH=1的稀硫酸中含有的H+数为0.1NA,故C错误;D项,由电荷守恒可得:[H+]+[Na+]=[OH-]+[CH3COO-],又因为溶液呈中性,所以[H+]=[OH-],[Na+]=[CH3COO-],因此CH3COOˉ数目等于Na+数目,为NA个,故D正确。综上,选D。

【题目】下列设计的实验方案能达到相应实验目的是( )
选项 | 实验目的 | 实验方案 |
A | 蛋白质发生了变性 | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 |
B | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol·Lˉ1CuSO4溶液,迅速产生较多气泡 |
C | 比较Ksp(BaCO3)、Ksp(BaSO4) | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
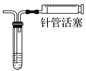
D | 通过观察液面差判断该装置的气密性 |
|
A. A B. B C. C D. D