题目内容
【题目】铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。
(1)铜元素在周期表中的位置是________________,Au位于第六周期,与Cu同族,写出Au基态原子的价电子排布式___________。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为____________。
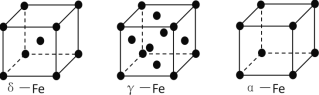
(3)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为_______________. 已知Fe原子半径为r pm,δ-Fe晶体的空间利用率为_________________。(只列式不化简)
(4)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中微粒之间的作用力是_________。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如图)相似,该晶体储氢后的化学式为_______________。
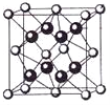
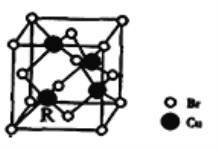
(5)一种铜的溴化物晶胞结构如下图所示其化学式是______________.已知该晶胞参数为anm,Cu的相对原子量为64,Br的相对原子量为80,阿伏加德罗常数为NA,求晶体密度ρ=_________g/cm3(只列式不化简).
【答案】第4周期ⅠB族 5d106s1 分子晶体 4:6:3  金属键 Cu3AuH8 CuBr
金属键 Cu3AuH8 CuBr 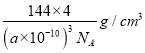
【解析】
(1)铜是29号元素,在元素周期表位置:第四周期、ⅠB族,价电子排布式为3d104s1,元素金(Au)处于周期表中的第六周期,与Cu同族,其价电子排布与Cu相似,Au原子的价电子排布式为5d106s1;
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。这此都是分子晶体具有的性质,;
(3)三种晶体中铁原子周围距离最近的铁原子个数之比为8:12:6=4:6:3;已知Fe原子半径为r pm,δ-Fe晶体的空间利用率=2个原子的体积与晶胞体积比,晶胞中铁原子的体积为:2×4/3×π×r3,体心立方中,体对角线上为三个铁原子相切,则体对角线为4r,晶胞边长为:![]() ,晶胞体积为:
,晶胞体积为:![]() ,空间利用率为:
,空间利用率为: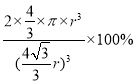
(4) 金属原子间形成金属键;氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
(5)该晶胞中Br原子个数=8×1/8+6×1/2=4,Cu原子个数为4,Br、Cu原子个数之比=4:4=1:1,其化学式为CuBr;若该溴化物晶胞参数为a pm,晶胞体积=(a×10-10cm)3,则该溴化物晶体的密度=m/V= =
=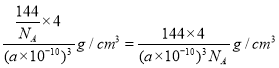
![]()

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案