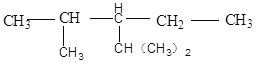题目内容
【题目】碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,不吸湿,相对稳定,是一种有开发价值的无机抗菌剂。某研发小组通过下列流程制备碱式次氯酸镁:
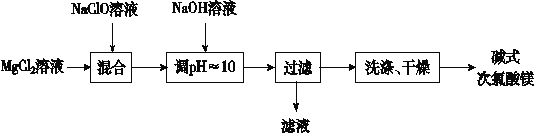
(1)上述流程中过滤操作需用的玻璃仪器有__________
(2)从上述流程中可以判断,滤液中可回收的主要物质是__________。
(3)NaClO溶液用Cl2与NaOH溶液反应获得,写出该反应的化学方程式:______________。
【答案】漏斗,烧杯,玻璃棒 NaCl Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
整个反应2MgCl2 + NaClO + 3NaOH + H2O = Mg2ClO(OH)3·H2O↓ + 4NaCl,过滤后滤液为氯化钠,得到的Mg2ClO(OH)3·H2O经过洗涤、干燥。
⑴上述流程中过滤操作需用的仪器主要是漏斗,烧杯,玻璃棒、滤纸、铁架台,而需要的玻璃仪器有漏斗,烧杯,玻璃棒,故答案为:漏斗,烧杯,玻璃棒;
⑵根据反应和质量守恒定律得出,滤液中可回收的主要物质是NaCl,故答案为:NaCl;
⑶ Cl2与NaOH溶液反应得到NaClO和氯化钠,该反应的化学方程式Cl2+2NaOH = NaCl +NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O。

【题目】苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
![]() +2KMnO4
+2KMnO4![]()
![]() +KOH+
+KOH+
2MnO2↓+H2O
![]() +HCl
+HCl![]()
![]() +KCl
+KCl
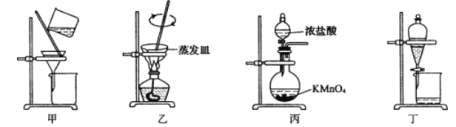
实验方法:一定量的甲苯和KMnO4溶液在100 ℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
![]()
已知:苯甲酸分子量122,熔点122.4 ℃,在25 ℃和95 ℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体B加入水中,加热溶解, | 得到白色晶体和无色滤液 | |
② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体, | | 白色晶体 |
(4)纯度测定:称取1.220 g产品,配成100 mL甲醇溶液,移取25.00 mL溶液,滴定,消耗KOH的物质的量为2.40×10-3mol。产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字)。
【题目】实验室以苯甲醛为原料制备间溴苯甲酸的反应如下:
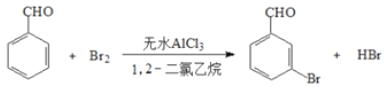
已知:(1)间溴苯甲醛温度过高时易被氧化
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如下图所示)缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
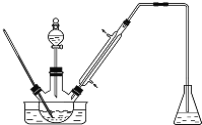
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液、有机层用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4·nH2O晶体
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是____________,锥形瓶中应为__________(填化学式)溶液
(2)步骤1反应过程出,为提高原料利用率,适宜的温度范围内(填序号)____________
A.>299℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10%NaHCO3溶液洗涤,是为了除去溶于有机层的____________(填化学式)
(4)步骤3中加入无水MgSO4固体的作用是___________________。
(5)步骤4中采用减压蒸馏,是为了防止_______________________________________。
(6)若实验中加入5.3g苯甲醛,得到3.7g间溴苯甲醛,则间溴苯甲醛产率为______________。