题目内容
【题目】化学工业中Mn可用作氧化剂、助燃剂、活性电极材料、催化剂、油漆和油墨的干燥剂等,碳酸锰矿可作为制备MnO2原料
(1)已知25℃,101kPa时有如下的三个热化学方程式
①MnCO3(s) ![]() MnO(s)+CO2(g) △H1=+116 6kJ/mol
MnO(s)+CO2(g) △H1=+116 6kJ/mol
②2MnO(s)+O2(g) ![]() 2MnO2(s) △H2=-272.0kJ/mol
2MnO2(s) △H2=-272.0kJ/mol
③2MnCO3(s)+O2(g) ![]() 2Mn2(s)+2CO2(g) △H3
2Mn2(s)+2CO2(g) △H3
则△H3=_________;反应②在________条件下(填“高温”、“低温”或“任何温度”)能自发进行。
(2)在密闭容器中投入足量的 MnCO3,在一定条件下发生反应:MnCO3(s) ![]() Mno(s)+CO2(g) △H1=+116.6kJ/mol。一定温度下,达到平衡状态时p(CO2)=bMPa
Mno(s)+CO2(g) △H1=+116.6kJ/mol。一定温度下,达到平衡状态时p(CO2)=bMPa
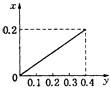
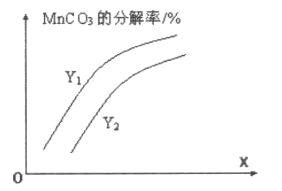
①温度、压强对碳酸锰平衡分解率的影响如图所示。图中Y1____Y2(填“>”、“<”或“=”)。
②保持温度不变,将体积扩大至原来的3倍,则容器内压强p(CO2)的变化范围为_______。
③若温度不变,将容器体积压缩至原来的一半,达到新平衡时,与原平衡状态相比,下列物理量一定不变的是________ (填字母)
A.CO2的质量 B. MnCO3的质量 C.MnCO3的分解率
D.化学平平衡常数 E.CO2的物质的量浓度
(3)在4L恒容密闭容器中,充入足量量的MnCO3(s)和a molO2(g),在一定温度下发生反应:MnCO3(s)+O2(g) ![]() 2MnO2(s)+2CO2(g),经过5min该反应刚好达到平衡状态,且该段时间内CO2的化学反应速率为0.2molL-1·min-1若该条件该反应的化学平衡常数K=0.5,则a=____。
2MnO2(s)+2CO2(g),经过5min该反应刚好达到平衡状态,且该段时间内CO2的化学反应速率为0.2molL-1·min-1若该条件该反应的化学平衡常数K=0.5,则a=____。
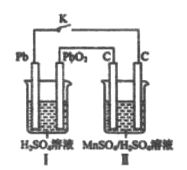
(4)现以铅蓄电池为电源,用石墨为电极,电解MnSO4和H2SO4混合液来制备MnO2,装置如图所示,阳极的电极反应式为___________,当蓄电池中有2mol H+被消耗时,则理理论上能生成MnO2________g
【答案】 -38.8kJ/mol 低温 < ![]() DE 10
DE 10 ![]() 43.5
43.5
【解析】(1) 根据盖斯定律,由①×2+②=③得ΔH3=2ΔH1+ΔH2=2×116-272=-38.8kJ/mol;反应②的正反应是气体分子数减小的反应,即熵减反应,ΔS<0,△H2<0,该反应在较低温度下能自发进行;正确答案:-38.8kJ/mol;低温。
(2)①从图像可知,减小压强,平衡右移,碳酸锰平衡分解率增大,因此Y1<Y2;正确答案:<。
②该反应的平衡常数为Kp=p(CO2);温度不变,平衡常数不变;假设减压(或扩大体积)时,平衡不移动,体积扩大至原来的3倍,则压强减小至原平衡的1/3,减压至p(CO2)=1/3 bMPa,即改变压强的瞬时,平衡已开始移动,压强的变化范围:![]() ;正确答案:
;正确答案:![]() 。
。
③MnCO3(s) ![]() Mno(s)+CO2(g) △H1=+116.6kJ/mol;若温度不变,将容器体积压缩至原来的一半,平衡左移,CO2的质量减小,A错误;MnCO3的质量增大,B错误;MnCO3的分解率减小,C错误;化学平衡常数只与温度有关,D错误;根据平衡常数为Kp=p(CO2),温度不变,平衡常数不变,CO2的物质的量浓度保持不变,E正确;正确选项DE。
Mno(s)+CO2(g) △H1=+116.6kJ/mol;若温度不变,将容器体积压缩至原来的一半,平衡左移,CO2的质量减小,A错误;MnCO3的质量增大,B错误;MnCO3的分解率减小,C错误;化学平衡常数只与温度有关,D错误;根据平衡常数为Kp=p(CO2),温度不变,平衡常数不变,CO2的物质的量浓度保持不变,E正确;正确选项DE。
(3)该段时间内CO2的化学反应速率为0.2molL-1·min-1,消耗CO2的浓度为1 molL-1;a molO2(g)的浓度为0.25a molL-1,
MnCO3(s)+O2(g) ![]() 2MnO2(s)+2CO2(g),
2MnO2(s)+2CO2(g),
起始量 0.25a 0
变化量 0.5 1
平衡量 0.25a-0.5 1
K=c2(CO2)/c(O2)= 0.5, 12/(0.25 a-0.5)= 0.5, a =10;正确答案:10。
4)铅蓄电池为电源,与二氧化铅相连的电极为阳极,溶液中锰离子失电子氧化为二氧化锰,极反应为![]() ;铅蓄电池总反应为Pb + PbO2 + 2H2SO4 == 2PbSO4↓ + 2H2O,转移电子2mol,有4molH+被消耗时,当有2mol H+被消耗时,转移电子1mol,根据
;铅蓄电池总反应为Pb + PbO2 + 2H2SO4 == 2PbSO4↓ + 2H2O,转移电子2mol,有4molH+被消耗时,当有2mol H+被消耗时,转移电子1mol,根据![]() 可知,生成MnO2的量为0.5 mol,质量为43.5 g;正确答案:
可知,生成MnO2的量为0.5 mol,质量为43.5 g;正确答案:![]() ;43.5。
;43.5。