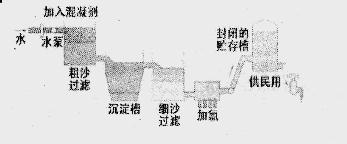
题目内容
自来水生产的流程示意图见下:
⑴ 混凝剂除去悬浮物质的过程 (填写序号)
①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
⑵ 实验室过滤操作所用到的玻璃仪器是 。
⑶ 我们有时感觉自来水“有漂白粉气味”是因为使用了氯气消毒,请写出有关的化学反应方程式 。
下列物质中, 可以作为氯气的代用品。(填写序号)
① 臭氧 ②NH3(液) ③K2FeO4 ④SO2
⑷ 有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有 离子交换树脂和 离子交换树脂的离子交换柱。(填“阴”或“阳”)
⑸ 测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.10mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62-
求水中的溶解氧量(以mg·g-1为单位)
⑴③(2分) Fe(OH)3(2分) ⑵ 漏斗 烧杯 玻璃棒(3分)
⑶ Cl2+H2O 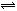 HCl+HClO(2分)①③(2分)⑷ 阳 阴(2分)⑸ 12.0mg·g-1(2分)
HCl+HClO(2分)①③(2分)⑷ 阳 阴(2分)⑸ 12.0mg·g-1(2分)
解析试题分析:⑴FeSO4水解成Fe(OH)2;4 Fe(OH)2 +2 H2O+ O2="4" Fe(OH)3
⑶消毒利用氯气与水生成的HClO的氧化性, 臭氧和 K2FeO4 (Fe为+6价)有强氧化性。
⑷有阴阳离子的交换。
考点:本题以工艺流程为基础,考元素及化合物、化学实验基本操作、化学计算等相关知识

 名校课堂系列答案
名校课堂系列答案下列说法中不正确的是
| A.亚硝酸钠不但是防腐剂,而且还有抗氧化作用 |
| B.污水处理可采用混凝法,明矾是一种常用的混凝剂 |
| C.加碘食盐中加入的是碘单质 |
| D.肉蛋类等富含蛋白质的食物多为酸性食物 |
化学与社会生活密切相关。下列说法中正确的是
| A.向海水中加人明巩[KAl(SO4)2 ?12H2O]可以使海水淡化 |
| B.接外加电源的负极以保护海水中的钢闸门 |
| C.高纯度的硅单质广泛用于制作光导纤维 |
| D.糖类、蛋白质和石油均是生命中的基础有机物 |
下图是某品牌罐头的食品标签:
根据你所学的知识判断该厂生产的该品牌罐头是否存在欺诈消费者的虚
假宣传________(填“是”或“否”)。
(2)分别列举出该罐头所使用的食品添加剂:
| 食品添加 剂类别 | 防腐剂 | 着色剂 | 甜味剂 | 酸味剂 | 食用 香精 | 增稠剂 | 营养 强化剂 |
| 食品添加 剂名称 | | | | | | | |
随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康
的有关问题:
(1)微量元素与人体健康密切相关。为此,我国启动了多项工程,帮助居民补充微量元素,预防疾病。例如为了解决 问题启动了“酱油加铁”工程;为预防碘缺乏症,启动了“食盐加碘”工程,就是在食盐中加入适量的 (填“碘化钾”、“碘酸钾”或“碘单质”)。
(2)现有下列几种物质
| A.食盐 | B.食醋 | C.苹果汁 | D.葡萄糖 E.青霉素 |
富含维生素C的是 ;应用最广泛的抗生素之一的是 ;可直接进入血液补充能量的是 ;食用过多会引起血压升高、肾脏受损的是 。
(3)服用药物时要对症下药。胃舒平(主要成分Al(OH)3)适合于治疗 (“感冒发热”、“细菌感染”或“胃酸过多”)。
(4)自然因素和人类活动都能产生大气污染物,大气污染的危害是多方面的,主要有形成酸雨、使全球气候变暖等。对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为 。
下列说法正确的是
| A.光导纤维的材料是晶体硅 |
| B.金属越活泼,发现和使用的年代越早 |
| C.合理使用化肥有利于提高农作物产量 |
| D.高毒、高效、高残留化合物可用作未来粮食生产的杀虫剂 |
下列说法不正确的是( )
| A.汽车尾气中有NOx ,主要是汽油不充分燃烧引起的 |
| B.日用铝制品表面覆盖着氧化膜,对金属起保护作用 |
| C.实验室常用粗锌和稀硫酸反应制取H2 |
| D.从海水中提取溴的过程涉及氧化还原反应 |