题目内容
(12分) A、B、C、D、E、F六种短周期元素,A元素的离子焰色反应为黄色。5.8 g B的氢氧化物恰好能与100 mL 2 mol·L—1盐酸完全反应;B原子核中质子数和中子数相等。F2在黄绿色气体C2中燃烧产生苍白色火焰。D元素原子的最外层电子数是次外层电子数的3倍;含E元素的化合物在自然界种类最多。
根据上述条件回答:
(1)C在周期表中的位置 ,其最高价为 。A的原子结构示意图为 ;
(2)A、D形成淡黄色化合物,其电子式为 ,该物质含有的化学键类型为 。
(3)C2与ADF溶液反应的离子方程式为: ;
(4)用电子式表示BC2的形成过程 。
(5) 元素D、E分别和F构成9e-微粒名称是 、 。
根据上述条件回答:
(1)C在周期表中的位置 ,其最高价为 。A的原子结构示意图为 ;
(2)A、D形成淡黄色化合物,其电子式为 ,该物质含有的化学键类型为 。
(3)C2与ADF溶液反应的离子方程式为: ;
(4)用电子式表示BC2的形成过程 。
(5) 元素D、E分别和F构成9e-微粒名称是 、 。
(1)第三周期ⅦA族(1分), +7(1分)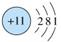
(2) (2分)离子键非极性键(2分)
(2分)离子键非极性键(2分)
(3)Cl2+2OH-=Cl-+ClO-+H2O(2分)
(4)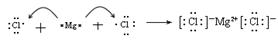 (2分)
(2分)
(5)羟基(1分)、甲基(1分)
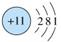
(2)
 (2分)离子键非极性键(2分)
(2分)离子键非极性键(2分)(3)Cl2+2OH-=Cl-+ClO-+H2O(2分)
(4)
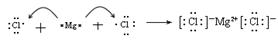 (2分)
(2分)(5)羟基(1分)、甲基(1分)
根据元素的核外电子排布及性质可知,A、B、C、D、E、F六种短周期元素分别是Na、Mg、Cl、O、C、H。
(1)氯元素是第ⅦA元素,最高正价是+7价。
(2)过氧化钠含有离子键和非极性键,其电子式为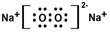 。
。
(3)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,方程式为
Cl2+2OH-=Cl-+ClO-+H2O。
(4)氯化镁是由离子键形成的离子化合物,其形成过程可表示为
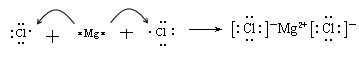 。
。
(5)O、C和H形成的9电子微粒可以通过其相应的10电子微粒水和甲烷得到,分别是-OH和-CH3。
(1)氯元素是第ⅦA元素,最高正价是+7价。
(2)过氧化钠含有离子键和非极性键,其电子式为
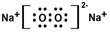 。
。(3)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,方程式为
Cl2+2OH-=Cl-+ClO-+H2O。
(4)氯化镁是由离子键形成的离子化合物,其形成过程可表示为
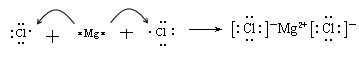 。
。(5)O、C和H形成的9电子微粒可以通过其相应的10电子微粒水和甲烷得到,分别是-OH和-CH3。

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目