题目内容
16.已知下列物质氧化Fe3+时,自身发生如下变化:Cl2→2Cl-,MnO4-→Mn2+,Cr2O72-→2Cr2+,H2O2→2H2O,如果分别用等物质的量的这些物质氧化足量的Fe2+,得到Fe3+最多的是( )| A. | Cr2O72- | B. | Cl2 | C. | MnO4- | D. | H2O2 |
分析 氧化还原反应的实质是电子的转移,在氧化还原反应中,氧化剂和还原剂之间得失电子的数目相等,根据元素化合价的变化数值可解答该题.
解答 解:假设氧化剂的物质的量均是1mol,则
Cl2→2Cl-,1molCl2可得2mol电子,
MnO4-→Mn2+,1molMnO4-得5mol电子,
Cr2O72-→2Cr3+,1molCr2O72-得6mol电子,
H2O2→2H2O,1molH2O2得2mol电子,
则分别用等物质的量的这些物质氧化足量的Fe2+,得到Fe3+最多的是Cr2O72-,
故选A.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,注意把握元素化合价的变化,为解答该题的关键,难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
10.下列电离方程式中,错误的是( )
| A. | H2CO3?H++HCO3-; HCO3-?H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | NaHS═Na++H++S2- | D. | CH3COOH?H++CH3COO- |
1.下列各组反应(表中物质均为反应物)中.反应刚开始时,放出氢气的速率最大的是 ( )
| 编号 | 金属(块状) | 酸的浓度及体积 | 反应温度/℃ |
| A | 0.4 molMg | 6 mol•L-1 硝酸 10 mL | 60 |
| B | 0.3 molMg | 3 mol•L-1盐酸 40 mL | 60 |
| C | 0.4 molFe | 3 mol•L-1盐酸 50 mL | 60 |
| D | 0.1 molMg | 3 mol•L-1 硫酸 10 mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
8.下列四种化合物分别催化加氢后,不能得到2-甲基戊烷的是( )
| A. | CH3CH=C(CH3)CH2CH3 | B. | (CH3)2C=CHCH2CH3 | ||
| C. | CH3CH=CHCH(CH3)2 | D. | CH2=CHCH2CH(CH3)2 |
 ;
; ;
; CH2CH2OOCH、
CH2CH2OOCH、 COOCH2CH3、
COOCH2CH3、 CH2COOCH3、
CH2COOCH3、 00CCH2CH3.
00CCH2CH3. 温下不与NaOH溶液反应
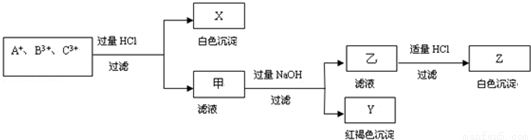
温下不与NaOH溶液反应 、C3+ 三种金属阳离子的水溶液发生了如下一系列变化:
、C3+ 三种金属阳离子的水溶液发生了如下一系列变化: