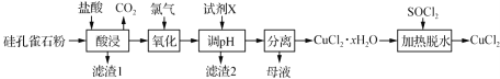
题目内容
【题目】次硫酸氢钠甲醛(NaHSO2HCHO2H2O)俗称吊白块,在印染、医药以及原子能工业中有广 泛应用。以 Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: 已知:次硫酸氢钠甲醛易溶于水,微溶于乙醇,具有强还原性,且在 120℃以上发生分解。
步骤 1:在三颈烧瓶中加入一定量 Na2SO3 和水,搅拌溶解,缓慢通入 SO2,至溶液 pH 约为 4,制得 NaHSO3溶液。
步骤 2:将装置 A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在 80~90℃下, 反应约 3h,冷却至室温,抽滤;
步骤 3:将滤液真空蒸发浓缩,冷却结晶。
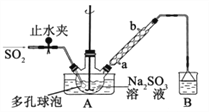
(1)装置 B的烧杯中应加入的溶液是_________;冷凝管中冷却水从_______填“a”或“b”)口进水。
(2)A 中多孔球泡的作用是________。
(3)冷凝管中回流的主要物质除 H2O 外还有________(填化学式)。
(4)写出步骤 2 中发生反应的化学方程式________。
(5)步骤 3 中在真空容器中蒸发浓缩的原因是________。
(6)为了测定产品的纯度,准确称取 2.0g 样品,完全溶于水配成 100mL 溶液,取 20.00mL 所配溶液, 加入过量碘完全反应后(已知 I2 不能氧化甲醛,杂质不反应),加入 BaCl2 溶液至沉淀完全,过滤、洗涤、 干燥至恒重得到白色固体 0.466g,则所制得的产品的纯度为________ 。
【答案】NaOH 溶液a增大气体与溶液的接触面积,加快吸收速率HCHONaHCO3+ HCHO+ Zn+ H2O= NaHSO2·HCHO+ Zn(OH)2防止温度过高使产物分解,也防止氧气将产物氧化77.00%
【解析】
试题(1)该实验是以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛,SO2作为尾气不能排放到空气中,装置B的作用是吸收SO2,所以装置B 的烧杯中应加入的溶液是NaOH溶液,A为三颈烧瓶, 冷凝水从下口进水,才有利于冷水在冷凝器中存在,冷凝效果更好;所以冷却水从a口进水。
(2)为了增大气体与溶液的接触面积,加快气体的吸收速率,A中放置了多孔球泡。
(3)HCHO具有挥发性,在80℃—90℃条件下会大量挥发,加冷凝管可以是HCHO冷凝回流提高HCHO的利用率。
(4)该实验是以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛,则步骤2中发生反应的化学方程式为NaHSO3+HCHO+Zn+H2O= NaHSO2HCHO+Zn(OH)2。
(5)次硫酸氢钠甲醛具有还原性,在敞口容器中蒸发浓缩,可以被空气中的氧气氧化变质,为了防止温度过高使产物分解,也防止氧气将产物氧化,在真空容器中进行蒸发浓缩。
(6)根据题意发生的离子反应为2H2O+HSO2-+2I2=SO42-+4I-+5H+,SO42-+Ba2+=BaSO4↓,得关系式为
NaHSO2HCHO2H2O—BaSO4
154 233
x 0.466 列方程解得:x=0.308
则所制得的产品的纯度为(0.308×5)÷2.0×100%=77%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案