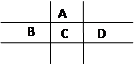题目内容
A、B、C、D四种短周期元素,且A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3 和BC2,A、D同主族,A的原子结构示意图如图,据此填空:

(1)A的元素名称为 。
(2)C元素的一种单质在碱性燃料电池中参加电极反应时的反应式为:
。
(3)A、B、C三种元素的原子,半径由小到大的顺序为 (用元素符号作答)。
(4)A、B和D最高价氧化物对应的水化物,酸性由强到弱的顺序为 (用对应酸的分子式作答)。若用下图装置验证这三种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ ,Ⅱ ,Ⅲ 。
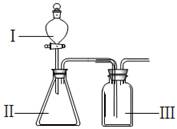
观察到的实验现象为 。
写出Ⅲ中现象对应的离子方程式 。

(1)A的元素名称为 。
(2)C元素的一种单质在碱性燃料电池中参加电极反应时的反应式为:
。
(3)A、B、C三种元素的原子,半径由小到大的顺序为 (用元素符号作答)。
(4)A、B和D最高价氧化物对应的水化物,酸性由强到弱的顺序为 (用对应酸的分子式作答)。若用下图装置验证这三种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ ,Ⅱ ,Ⅲ 。

观察到的实验现象为 。
写出Ⅲ中现象对应的离子方程式 。
(14分)(1)硅 (2)O2+4e-+2H2O=4OH- (3)O S Si (4)H2SO4>H2CO3>H2SiO3
ⅠH2SO4 ⅡNa2CO3 ⅢNa2SiO3 (合理答案均可)
Ⅱ中有气泡生成 Ⅲ中出现白色胶状沉淀 H2O+CO2+SiO32-=H2SiO3 +CO32-
ⅠH2SO4 ⅡNa2CO3 ⅢNa2SiO3 (合理答案均可)
Ⅱ中有气泡生成 Ⅲ中出现白色胶状沉淀 H2O+CO2+SiO32-=H2SiO3 +CO32-
试题分析:根据A的原子结构示意图可知,x=2,则y=14,即A是硅元素。A、D同主族,且是短周期元素,所以D是碳元素。B、C同主族,B、C可形成共价化合物BC3,且A、B为同周期元素,所以B是硫元素,C是氧元素。
(1)A的元素名称是硅。
(2)氧气在碱性燃料电池中在正极通入,则电极反应式是O2+4e-+2H2O=4OH-。
(3)同周期自左向右原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,则A、B、C三种元素的原子,半径由小到大的顺序为O S Si。
(4)非金属性越强,最高价氧化物的水化物的酸性越强,则A、B和D最高价氧化物对应的水化物,酸性由强到弱的顺序为H2SO4>H2CO3>H2SiO3。根据较强酸制备较弱酸可知,Ⅰ中加入H2SO4,Ⅱ中加入Na2CO3,Ⅲ中加入Na2SiO3。实验现象是Ⅱ中有气泡生成,Ⅲ中出现白色胶状沉淀。Ⅲ中现象对应的离子方程式是H2O+CO2+SiO32-=H2SiO3 +CO32-。
点评:该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目