题目内容
1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值。注意阅读分析材料,据此完成下列要求。
(1)预测周期表中电负性最大的元素应为 (填元素符号);估计钙元素的电负性的取值范围: <X< 。
(2)简述元素电负性X的大小与元素金属性、非金属性之间的关系
。
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的键一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为 ;上表中最易形成离子键的两种元素的电负性之差为 。
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(2)简述元素电负性X的大小与元素金属性、非金属性之间的关系
。
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的键一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为 ;上表中最易形成离子键的两种元素的电负性之差为 。
(6分)(1)F 0.8 1.2
(2) 电负性越大,非金属性越强,金属性越弱,反之亦然
(3)共价键(1分) 3.2
(2) 电负性越大,非金属性越强,金属性越弱,反之亦然
(3)共价键(1分) 3.2
试题分析:(1)电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以非金属性越强电负性越强,故电负性最强的物质在周期表的右上角为F元素;由表中数据可知,同周期自左而右电负性逐渐增大,同主族自上而下电负性逐渐降低,非金属性越强电负性越强,故金属性越强电负性越小,所以钙元素的电负性比K元素大,但小于Mg元素的电负性,即0.8<X(Ca)<1.2。
(2)由表中数据可知,同周期自左而右电负性逐渐增大,同主族自上而下电负性逐渐降低,故非金属性越强电负性越大,金属性越强电负性越小。
(3)AlCl3中两电负性之差为1.5,Br元素的电负性小于Cl元素电负性,AlBr3中两电负性之差小于1.5,故AlBr3中化学键为共价键。
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固和训练,旨在培养学生灵活运用基础知识解决实际问题的能力,清楚主族元素电负性的递变规律是解题关键。有利于培养学生的逻辑推理能力和发散思维能力。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
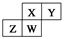 , 四种元素均为主族元素。下列关于这四种元素及其化合物的说法中正确的是( )
, 四种元素均为主族元素。下列关于这四种元素及其化合物的说法中正确的是( )
 Si + 2CO↑ 可知非金属性:C > Si
Si + 2CO↑ 可知非金属性:C > Si