题目内容
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
温度/oC | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)该反应的化学平衡常数表达式为K=______________________。
(2)上述正向反应是_________________(填“放热”或“吸热”)反应。
(3)某温度下,上述反应达到平衡时,恒容、升高温度,原化学平衡向_________(填“正”或“逆”)反应方向移动,正反应速率___________(填“增大”“减小”或“不变”),容器内混合气体的压强_____________(填“增大”“减小”或“不变”)。
(4)有830oC时发生上述反应,按下表中的物质的量投入恒容反应器,其中在向正反应方向进行的有____________(选填A、B、C、D)。
A | B | C | D | |
n(CO2)/mol | 3 | 1 | 0 | 1 |
n(H2)/mol | 2 | 1 | 0 | 1 |
n(CO)/mol | 1 | 2 | 3 | 0.5 |
n(H2O)/mol | 5 | 2 | 3 | 2 |
【答案】 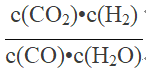 放热 逆 增大 增大 B、C
放热 逆 增大 增大 B、C
【解析】(1)已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数K=
H2(g)+CO2(g)的平衡常数K=![]() ;正确答案:
;正确答案: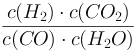 。
。
(2)由表中数据可知升高温度化学平衡常数减小,生成物浓度减小,反应物浓度增加,平衡逆向移动,所以△H<0,属于放热反应;正确答案:放热。
(3)对于放热反应,升高温度虽然反应逆向移动,但正逆反应速率都增大;反应前后化学计量数不变且反应物和生成物都是气体,升高温度平衡逆向移动,所以气体的物质的量不变,但是升高温度气体分子的间隔变大,导致压强增大;正确答案:逆;增大;增大。
(4)根据830℃时,平衡常数K=1计算; 浓度商Q=![]() >1,反应向逆反应方向移动,A错误; 浓度商Q=
>1,反应向逆反应方向移动,A错误; 浓度商Q=![]() <1,反应向正反应方向移动,B正确; 只有反应物,反应向正反应方向移动,C正确; 浓度商Q=
<1,反应向正反应方向移动,B正确; 只有反应物,反应向正反应方向移动,C正确; 浓度商Q=![]() =1,达到平衡状态,平衡不移动,D错误;正确选项BC。
=1,达到平衡状态,平衡不移动,D错误;正确选项BC。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案【题目】下列除杂试剂的选择或除杂操作正确的是( )
选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
A | CO2(SO2) | 饱和Na2CO3溶液 | 将气体通过足量的Na2CO3溶液 |
B | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
C | NO2(NO) | H2O | 将气体通入水中 |
D | NH3(H2O) | 浓硫酸 | 气体通入浓硫酸 |
A.AB.BC.CD.D
【题目】下列陈述I、Ⅱ正确并且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 干燥的氯气有强氧化性 | 氯水能使有色布条褪色 |
B | SO2是酸性氧化物 | SO2可使含有酚酞的NaOH溶液褪色 |
C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
D | 用淀粉-KI溶液鉴别FeCl2 | Fe2+有氧化性 |
A. A B. B C. C D. D
