题目内容
【题目】在实验室中模拟“侯氏制碱法”,其实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,一段时间后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体,进而生产出纯碱。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接_______,_______接______;b接_______(填接口序号)。
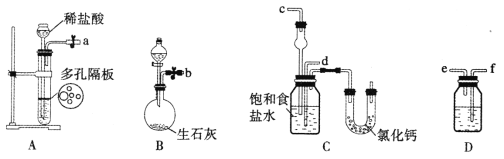
(2)A中常选用的固体反应物为_________;D中应选用的液体为____________。
(3)第二步中让___________装置先发生反应(填装置序号)。
(4)C中用球形干燥管而不用直导管,其作用是____________________;装有无水CaCl2的U形管的作用是__________________________。
(5)第三步分离出NaHCO3固体的操作是__________________________。
(6)第四步中所加固体粉末化学式为___________。所得的晶体中常含有少量的NaCl和NaHCO3(共约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象:____________________________________。
【答案】f e d c 石灰石 饱和碳酸氢钠溶液 B 防止倒吸 吸收多余的氨气 过滤 NaCl 取少量样品于试管中,用酒精灯加热,看到试管上端有白烟生成(或试管口有白色晶体),最后固体大部分消失、剩余极少量的固体,从而证明所得固体的成分大部分是氯化铵
【解析】
由“侯氏制碱法”的原理可知:实验时需先向饱和食盐水中通入足量的氨气,然后再通入二氧化碳气体,装置A为二氧化碳的发生装置,装置B为氨气的发生装置,装置C为反应装置,装置D为二氧化碳的净化装置,据此分析解答。
(1)装置A产生CO2,装置B产生NH3,装置D除去二氧化碳中的HCl,氨气通入C中应防止倒吸,则b接c, a接f、e接d,故答案为:f、e、d、c;
(2)A装置是制备二氧化碳气体的反应,一般采用盐酸与CaCO3反应来制取,所以A中固体反应物为石灰石,生成的二氧化碳气体中含有氯化氢,若不除去,会影响碳酸氢钠的产率,所以应用饱和碳酸氢钠溶液除去二氧化碳中的HCl,故答案为:石灰石、饱和碳酸氢钠溶液;
(3)因为氨气极易溶解于水,二氧化碳气体在水中溶解性较小,所以实验时,饱和食盐水中应先通入氨气,再通入二氧化碳气体,有利于气体的吸收,实验操作过程中,应让B装置先发生反应,故答案为:B;
(4)氨气极易溶于水,用直导管向饱和氯化钠溶液中通入氨气,容易发生倒吸,C中用球形干燥管,可以防止倒吸;多余的NH3能与CaCl2结合生成CaCl2·8NH3,所以装有无水CaCl2的U形管可吸收多余的NH3,故答案为:防止倒吸;吸收多余的氨气;
(5)第三步中得到的NaHCO3在溶液中以晶体的形式析出,分离出NaHCO3晶体采用的方法为过滤,故答案为:过滤;
(6)实验第四步可向溶液中加入NaCl粉末,有利于NH4Cl晶体的析出;若所得的晶体大部分为NH4Cl晶体,经过充分加热,NH4Cl会分解成气体,余下少量的氯化钠和碳酸钠等固体,故答案为:NaCl;取少量样品于试管中,用酒精灯加热,看到试管上端有白烟生成(或试管口有白色晶体),最后固体大部分消失、剩余极少量的固体,从而证明所得固体的成分大部分是氯化铵。

【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色粉末,常用作催化剂和陶瓷着色剂,300 ℃以上时分解生成 3 种氧化物。为确定其组成,某同学在实验室进行了有关的探究。 请回答下列问题:

(1)装置 E 中仪器的名称是_____。
(2)甲、乙两装置可分别选取下列装置_____、_____(填字母,装置可重复选取)。

(3) 安装好实验仪器,检查装置气密性;称取一定量的碱式碳酸镍样品,放入硬质玻璃管内; 加热硬质玻璃管,当装置 C 中_____(填实验现象)时,停止加热;打开活塞 K,缓缓通入一段时间空气后,结束实验。
(4)装置 A 的作用是______________________________________________________________________。
(5)实验前后测得下表所示数据:
装置 B 中样品质量/g | 装置 C 质量/g | 装置 D 质量/g | |
实验前 | 3.77 | 132.00 | 41.00 |
实验后 | 2.25 | 133.08 | 41.44 |
已知碱式碳酸镍中 Ni 化合价为+2 价,则该碱式碳酸镍的化学式为_______________________________。
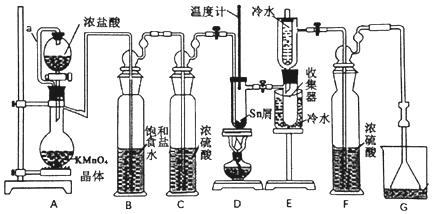
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如图。
已知:①SnCl2、SnCl4有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | ﹣33 | 114 |
②SnCl4极易水解生成SnO2H2O。
回答下列问题:
(1)导管a的作用是____________________________________________________________,装置A中发生反应的离子方程式为________________________________________。
(2)当观察到装置F液面上方______________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是____________________________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为____________________________________________________________。
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,可采取的措施是____________________________________________________________。
(5)滴定分析产品中2价Sn(II)的含量:用分析天平称取5.000 g产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用0.1000 molL﹣1的碘标准溶液滴定至终点时消耗20.00 mL,则产品中Sn(II)的含量为____________________。