题目内容
【题目】实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )
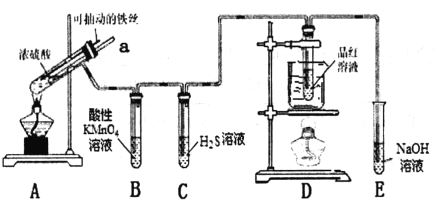
A. 装置C中产生淡黄色的沉淀,体现了SO2的氧化性
B. 装置E的作用是吸收未反应的SO2,防止污染空气
C. 装置D中品红溶液褪色后加热又变红色,可验证SO2溶于水显酸性
D. 实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
【答案】C
【解析】
A. 装置C中发生的反应为SO2+2H2S=3S![]() +2H2O产生淡黄色的沉淀为S,体现了SO2的氧化性,故A正确;B. 装置E中的试剂为NaOH溶液,可以和SO2,故装置E的作用是吸收未反应的SO2,防止污染空气是正确的;故B正确;C.品红溶液褪色加热又变红色,体现了SO2的漂白性,故C错误; D.导管a的作用是使内外压强相同,防止装置B中的溶液倒吸,故D正确。答案:C。
+2H2O产生淡黄色的沉淀为S,体现了SO2的氧化性,故A正确;B. 装置E中的试剂为NaOH溶液,可以和SO2,故装置E的作用是吸收未反应的SO2,防止污染空气是正确的;故B正确;C.品红溶液褪色加热又变红色,体现了SO2的漂白性,故C错误; D.导管a的作用是使内外压强相同,防止装置B中的溶液倒吸,故D正确。答案:C。

【题目】下表是元素周期表简化后的一部分,请用标出的元素以及对应的物质回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
1 | ① | ||||||
2 | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | ⑩ |
(1)写出由①和③两种元素组成的不带电的两种物质的化学式:________、_______;
(2)①~⑩号元素中最高价氧化物对应的水化物酸性最强的酸的化学式为:_______;
(3)⑩的最高价氧化物对应的水化物与⑧的最高价氧化物在加热的条件下生成盐和水的化学方程式为:___________________________________________________________;
(4)将⑤的单质通入④的常规氢化物中,反应剧烈,对应的化学方程式为:________;
(5)相同条件下⑤⑥⑦⑧四种元素的原子半径由大到小的顺序是:________________。
【题目】过渡元素在生活、生产和科技等方面有广泛的用途。
(1)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是________(填序号)。
A.PFS中铁显+2价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
Mn | Fe | ||
电离能 | I1 | 717 | 759 |
(kJ·mol-1) | I2 | 1 509 | 1 561 |
I3 | 3 248 | 2 957 |
(2)PFS中SO42-采取__________杂化,空间构型是_________。
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬与甲基丙烯酸根的配合物为
①该化合物中铬的化合价为___________。
②该化合物中一个Cr的配位数为________。
③甲基丙烯酸分子中C原子的杂化方式有___________________________________。
(4)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表.
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为__________________________________________________