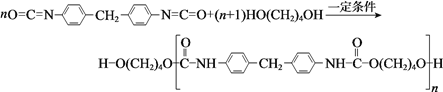
题目内容
【题目】下列叙述正确的是( )
A. 碘晶体受热转变为碘蒸气,吸收的热量用于断裂共价键
B. 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C. 多电子原子中,在离核较近的区域内运动的电子能量较高
D. 两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键
【答案】B
【解析】A、碘单质的晶体属于分子晶体,加热晶体碘使之变成蒸气克服分子间作用力,故A错误;B、从ⅢB族到ⅡB族10个纵行为副族及第Ⅷ族元素,均为金属元素,故B正确;C、多电子原子中,在离核较远的区域内运动的电子能量较高,在离核较近的区域内运动的电子能量较低,故C错误;D、含金属元素的化合物如氯化铝中只含共价键,故D错误;故选B。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】化学变化中伴随着能量的转化,在理论研究和生产生活中有很重要的作用。
Ⅰ.催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
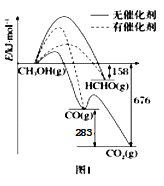
(1)人们常用催化剂来选择反应进行的方向.图1所示为一定条件下1 mol CH3OH 与O2发生反应时.生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成________(填“CO”、“CO2”或“HCHO”);2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=________。
Ⅱ.第三代混合动力车,可以用电动机,内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(2)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol 水蒸气放热550kJ;若1 g水蒸气转化为液态水放热2.5kJ,则辛烷燃烧热的热化学方程式为_____________。

(3)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为: H2+2NiOOH![]() 2Ni(OH)2。
2Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时.乙电极周围溶液的pH______(填“增大”,“减小”或“不变”),该电极的电极反应式为_______________。
(4)远洋轮船的钢铁船体在海水中易发生电化学有腐蚀中的______腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的______(填“正”或“负”)极相连。
Ⅲ.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
阳离子 | Ag+ Na+ |
阴离子 | NO3- SO42 - Cl- |
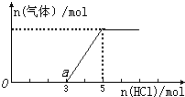
如图1所示的装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液。电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如图2所示。据此回答下列问题:
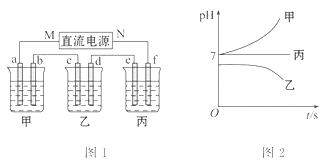
(5)M为电源的______极(填写“正”或“负”),甲为__________(填写化学式)。
(6)计算电极f上生成的气体在标准状况下的体积_________。
(7)写出乙烧杯中的电解池反应______________________。
(8)若电解后甲溶液的体积为25 L,则该溶液的pH为_______。
(9)要使丙恢复到原来的状态,应加入_______g______。(填写化学式)