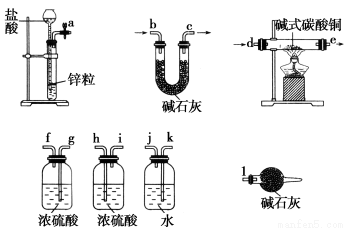
题目内容
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子。A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。请回答下列问题:
(1)C的最高价氧化物对应水化物的化学式为 ,
其中含有的化学键类型为 。
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 。
(3)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是 (填序号)。
①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
(1)NaOH 离子键和共价键
(2)2I-+ClO-+H2O=I2+Cl-+2OH-
(3)①③
【解析】解答本题时应注意以下两点:
(1)C为短周期元素,且C的最高价氧化物的水化物能电
离出电子数相等的阴、阳离子,确定C元素;
(2)由B的核外电子排布特点,最外层电子数是次外层电子数的3倍,可确定B元素。

下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质
可在空气中燃烧。
W | X | Y |
|
| Z |
请回答下列问题:
(1)Z的元素符号是 ,写出Z的原子结构示意图: 。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,该反应的离子方程式为 。
(3)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中Z用元素符号表示)
编号 | 性质推测 | 化学方程式 |
示例 | 氧化性 | H2ZO3+4HI=Z↓+2I2+3H2O |
1 |
|
|
2 |
|
|
(4)由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式: 。
某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3-、NO3-、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出)。

请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填)。
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | |
化学式或离子符号 |
|
|
| |
(2)待测溶液中是否有SO32-、SO42- 。若气体D遇空气变红色,则生成沉淀D时肯定发生的反应的离子方程式为 ,形成沉淀B时反应的离子方程式为 。
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是 。