题目内容
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4 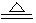 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
| A.CO2是氧化产物 |
| B.H2C2O4在反应中被氧化 |
| C.H2C2O4的氧化性强于ClO2的氧化性 |
| D.ClO2作水处理剂时,利用了其强氧化性 |
C
解析

Na2O2、CaC2都能与水反应,且反应中都有气体放出。下列说法正确的是
| A.都属于氧化还原反应 | B.生成的气体均为氧化产物 |
| C.反应物水均作氧化剂 | D.反应均放热 |
甲乙两种非金属,能说明甲比乙的非金属性强的是( )
①甲比乙容易与H2化合;②甲的气态氢化物比乙的气态氢化物稳定;③甲的氧化物对应的水化物的酸性比乙的氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。
| A.①②③ | B.只有⑤ | C.①②③④⑤ | D.①② |
科学家最近研究出一种环保,安全的储氢方法,其原理可表示为:
NaHCO3+H2 HCOONa+H2O,下列有关说法不正确的是( )
HCOONa+H2O,下列有关说法不正确的是( )
| A.储氢、释氢过程均有能量变化 |
| B.NaHCO3、HCOONa均含有离子键和共价键 |
| C.储氢过程中,NaHCO3被还原 |
| D.释氢过程中,每消耗0.1mol H2O放出2.24L的H2 |
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是
| A.这“某物质”具有还原性 |
| B.CuH与盐酸反应,可能产生H2 |
| C.CuH与足量的稀硝酸反应:CuH + 3H+ + NO3—= Cu2++ NO↑+ 2H2O |
| D.CuH在氯气中燃烧:CuH + Cl2=" CuCl" + HCl |
将0.195g锌粉加入到20.0 mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M | B.M2+ | C.M3+ | D.MO2+ |
常温常压下过氧化钠可与CO2反应,与CO不反应。现将CO2、CO的混合气体在一定条件下和足量过氧化钠充分反应后,若固体质量增加了28 g,下列说法正确的是
| A.反应过程中,电子转移数为2NA |
| B.固体生成物的质量为106 g |
| C.CO可能有剩余 |
| D.反应后一定生成11.2 L氧气 |
铜的冶炼大致可分为:
(1)富集,将硫化物矿进行浮选
(2)焙烧,主要反应:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣)
(3)制粗铜,在1200 ℃发生的主要反应:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑
(4)电解精炼
下列说法正确的是
| A.上述焙烧过程的尾气均可直接排空 |
| B.由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2 |
| C.在反应2Cu2O+Cu2S=6Cu+SO2↑中,作氧化剂的只有Cu2O |
| D.电解精炼时,粗铜应与外电源负极相连 |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3—→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是
| A.生成40.0 L N2(标准状况) |
| B.有0.250 mol KNO3被氧化 |
| C.转移电子的物质的量为1.25 mol |
| D.被还原的N原子的物质的量为3.75 mol |