题目内容
有一包白色粉末,取出少量溶于水,用铂丝蘸取少许溶液,在无色火焰上灼烧,火焰呈黄色,若透过蓝色钴玻璃观看,则呈浅紫色。另取少量粉末加热,没有气体产生,但加入稀盐酸后,则有无色无味的气体生成,此气体能使澄清石灰水变浑浊,继续加稀盐酸至过量后,再加入硝酸钡溶液,出现白色沉淀。试问:白色粉末中肯定含有哪几种离子?写出上述变化的离子方程式。
含有K+、Na+、CO 、SO
、SO
离子方程式为:CO +2H+
+2H+ CO2↑+H2O
CO2↑+H2O
Ca2++2OH-+CO2 CaCO3↓+H2O
CaCO3↓+H2O
Ba2++SO
 BaSO4↓
BaSO4↓
 、SO
、SO
离子方程式为:CO
 +2H+
+2H+ CO2↑+H2O
CO2↑+H2OCa2++2OH-+CO2
 CaCO3↓+H2O
CaCO3↓+H2OBa2++SO

 BaSO4↓
BaSO4↓从焰色反应可知粉末中含有K+、Na+。加热无气体放出,说明无HCO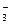 ,加入盐酸放出的无色无味气体能使石灰水变浑,说明有CO
,加入盐酸放出的无色无味气体能使石灰水变浑,说明有CO ;在酸性环境下加入Ba(NO3)2有白色沉淀,说明溶液中有SO
;在酸性环境下加入Ba(NO3)2有白色沉淀,说明溶液中有SO ,所以粉末中含有K+、Na+、CO
,所以粉末中含有K+、Na+、CO 、SO
、SO 。
。
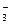 ,加入盐酸放出的无色无味气体能使石灰水变浑,说明有CO
,加入盐酸放出的无色无味气体能使石灰水变浑,说明有CO ;在酸性环境下加入Ba(NO3)2有白色沉淀,说明溶液中有SO
;在酸性环境下加入Ba(NO3)2有白色沉淀,说明溶液中有SO ,所以粉末中含有K+、Na+、CO
,所以粉末中含有K+、Na+、CO 、SO
、SO 。
。
练习册系列答案
相关题目

 ,分别含有下列选项中的一种杂质。取等质量的样品,分别向这些样品中加入2mol/L盐酸,均完全反应生成CO2,且所耗盐酸的体积也均相同。这四种样品中Na2CO3的质量百分比最小的是( )
,分别含有下列选项中的一种杂质。取等质量的样品,分别向这些样品中加入2mol/L盐酸,均完全反应生成CO2,且所耗盐酸的体积也均相同。这四种样品中Na2CO3的质量百分比最小的是( )