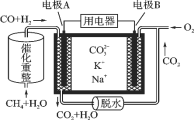
题目内容
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如图:
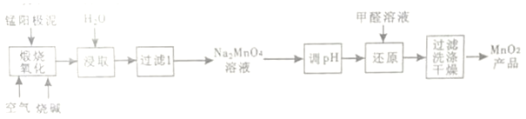
(1)“煅烧氧化”时,1molMnO煅烧完全转化为Na2MnO4失去电子___mol;
(2)为提高Na2MnO4的浸取速率,可采取的措施有___(列举2点)
(3)“调pH”是将溶液pH调至约为10,写出用pH试纸测定溶液pH的操作_____。
(4)MnO2煅烧反应的化学方程式为_____。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1.准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2.然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是___;产品中MnO2的质量分数为ω(MnO2)=___(列出计算的表达式即可)。
【答案】4mol 固体进行粉碎,提高浸取温度,充分搅拌等 取一小段pH试纸置于表面皿中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH 2MnO2+4NaOH+O2![]() 2Na2MnO4+2H2O 滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去
2Na2MnO4+2H2O 滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去 ![]() ×100%
×100%
【解析】
(1)准确判断MnO和Na2MnO4中锰元素化合价,据此计算1molMnO煅烧完全转化为Na2MnO4失去电子数目;
(2)根据常见的浸取率的方法结合题意分析解答;
(3)根据用pH试纸测定溶液pH的实验操作分析解答;
(4)根据流程图,MnO2在空气中与烧碱混合煅烧反应后生成Na2MnO4,据此书写反应的化学方程式;
(5)当溶液里存在C2O42-时,滴加紫色KMnO4溶液,溶液紫色褪去,仍为无色,据此判断反应达到滴定终点;依据方程式:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O和Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4进行计算解答。
(1)“煅烧氧化”时MnO→Na2MnO4锰由+2价变成+6价,失去电子为4e-,1mol MnO煅烧完全失去电子的物质的量为4mol,故答案为:4mol;
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有:煅烧后固体进行粉碎、适当提高浸取温度、充分搅拌等,故答案为:煅烧后固体进行粉碎、适当提高浸取温度或充分搅拌;
(3)用pH试纸测定溶液pH的操作为:取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH,故答案为:取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH;
(4)根据流程图,MnO2在空气中与烧碱混合煅烧反应后生成Na2MnO4,反应的化学方程式为2MnO2+4NaOH+O2![]() 2Na2MnO4+2H2O,故答案为:2MnO2+4NaOH+O2
2Na2MnO4+2H2O,故答案为:2MnO2+4NaOH+O2![]() 2Na2MnO4+2H2O;
2Na2MnO4+2H2O;
(5)当溶液里存在C2O42-时,滴加紫色KMnO4溶液,溶液紫色褪去,仍为无色,所以滴定终点判断依据为:滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去;依据方程式:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O和Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4,
5H2C2O4~~~~2KMnO4
5 2
![]() ×c2V2×10-3 c2V2×10-3
×c2V2×10-3 c2V2×10-3
H2C2O4~~Na2C2O4~~MnO2;
1 1
c1v1×10-3-![]()
则 n(MnO2)=(c1v1×10-3-![]() ×c2V2×10-3)mol,m(MnO2)=n(MnO2)×M(MnO2)=(c1v1×10-3-
×c2V2×10-3)mol,m(MnO2)=n(MnO2)×M(MnO2)=(c1v1×10-3-![]() ×c2V2×10-3)mol×87g/mol=87(c1v1×10-3-
×c2V2×10-3)mol×87g/mol=87(c1v1×10-3-![]() ×c2V2×10-3)g,产品中MnO2的质量分数为ω(MnO2) =
×c2V2×10-3)g,产品中MnO2的质量分数为ω(MnO2) =![]() ×100%,故答案为:滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去;
×100%,故答案为:滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去;![]() ×100%。
×100%。

【题目】下列根据实验事实得出的结论错误的是( )
实验事实 | 结论 | |
A. | 某溶液中加入BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
B. | 加热时,铜能与浓硫酸反应 | 浓硫酸有强氧化性 |
C. | 某分散系具有丁达尔效应 | 该分散系是胶体 |
D. | Al(OH)3既能与盐酸反应,也能与NaOH溶液反应 | Al(OH)3是两性氢氧化物 |
A.AB.BC.CD.D