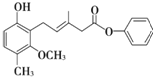
题目内容
【题目】下列说法正确的是( )
A.向久置的氯水中滴入石蕊试液溶液,先变红后褪色
B.欲除去Cl2中少量HCl气体,将此混合气体通过盛饱和食盐水的洗气瓶
C.漂白粉有效成分是CaCl2和 Ca( ClO)2,应密封保存
D.实验有用MnO2和浓盐酸加热法制Cl2时,若有14.6gHCl参加反应,则可制得3.55gCl2
【答案】B
【解析】
A.新制的氯水中,Cl2有一部分与水发生反应:Cl2+H2OHCl+HClO,而久置的氯水,由于HClO见光分解,溶液中HClO浓度逐渐减小,使Cl2与水的反应直至趋于完全,最终溶液将变为盐酸溶液,不含有HClO,有酸性而无漂白性,因此,向久置氯水中滴入石蕊试液,溶液只变红而不褪色,A错误;
B.将Cl2和HCl的混合气体通过入饱和食盐水中,HCl因易溶于水而被吸收掉,Cl2虽然能溶于水中,但由于饱和食盐水中Cl-浓度大,使Cl2与H2O反应受到抑制,从而减少了Cl2被水吸收的量,B正确;
C.Ca(ClO)2是漂白粉的有效成分,CaCl2不是,但为了避免漂白粉因与空气接触而变质,漂白粉应密封保存,C错误;
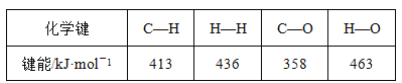
D.MnO2与浓盐酸反应生成Cl2:MnO2(浓)+4HCl![]() MnCl2+Cl2↑+2H2O,根据方程式,146gHCl能生成71g氯气,则14.6gHCl能生成氯气7.1g,D错误;
MnCl2+Cl2↑+2H2O,根据方程式,146gHCl能生成71g氯气,则14.6gHCl能生成氯气7.1g,D错误;
故选B。

【题目】某工业废水中仅含表中的离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)Ⅲ中加入少量盐酸生成无色气体的离子方程式是____________________。
(2)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为___________mol/L(精确到千分位)。
(3)甲同学最终确定原溶液中所含离子是__________________。
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为_____________g。
【题目】第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物,单质铁、砷及它们的化合物广泛应用于超导体材料等领域,请回答下列问题:
(1)Fe2+的核外电子排布式为_________________。
(2)NH3是一种很好的配体,NH3的沸点______(填“>”“=”或“<”)AsH3。
(3)N原子核外有______种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为_____。
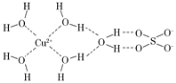
(4)科学家通过X射线测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力为________。
(5)As的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是________________。
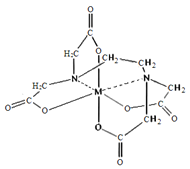
(6)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是_______,Fe3+的配位数为______。