题目内容
已知①CH3OH(g)+H20(g)=O2(g)+3H2(g) △H=+49.O kJ/mol
②CH3OH(g)+1/202(g)=CO2(g)+2H2(g) △H=-192.9 kJ/m01
下列说法正确的是 ( )
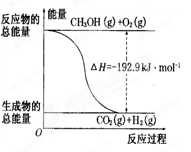
②CH3OH(g)+1/202(g)=CO2(g)+2H2(g) △H=-192.9 kJ/m01
下列说法正确的是 ( )
| A.CH30H转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物的总能量 |
| C.根据②推知反应:CH3OH(l)+1/202(g)=CO2(g)+2H2(g)△H>一192.9 kJ/mol |
| D.反应②的能量变化如图所示 |

C
试题分析:A、若发生反应②CH3OH转变为H2放出热量,错误;B、反应①为吸热反应,反应物的总能量低于生成物的总能量,错误;C、液态CH3OH的能量低于气态CH3OH的能量,所以放出的热量减小,?H增大,正确;D、反应②反应1mol CH3OH和1/2mol O2生成1mol CO2和2mol H2时的放热—192.9kj/mol,与图像不符,错误。

练习册系列答案
相关题目

 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol CH3OH(g)
CH3OH(g)