题目内容
在一个容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生反应:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
实验测得在300℃和500℃时,甲醇的物质的量(mol)随时间的变化如下表所示。
下列说法正确的是
A.该反应的ΔH>0,升高温度,化学平衡常数K增大
B.300℃时,前20 min内的反应速率v(H2)="0.003" mol·L-1·min-1
C.采取加压、增大c(H2)、加入合适的催化剂等措施都能提高CO的转化率
D.500℃时,在起始时向容器中加入0.1 mol CO和0.3 mol H2,可计算出反应达平衡后甲醇的浓度
CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)实验测得在300℃和500℃时,甲醇的物质的量(mol)随时间的变化如下表所示。
| | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min |
| 300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
| 500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
A.该反应的ΔH>0,升高温度,化学平衡常数K增大
B.300℃时,前20 min内的反应速率v(H2)="0.003" mol·L-1·min-1
C.采取加压、增大c(H2)、加入合适的催化剂等措施都能提高CO的转化率
D.500℃时,在起始时向容器中加入0.1 mol CO和0.3 mol H2,可计算出反应达平衡后甲醇的浓度
D
试题分析:A、300℃平衡时甲醇的物质的量大于500℃平衡时甲醇的物质的量,所以升高温度平衡逆向移动,正向是放热反应,ΔH<0,错误;B、300℃时,前20 min内甲醇的物质的量增加0.120mol,则氢气的物质的量减少0.240mol,浓度改变0.120mol/L,所以前20 min内的反应速率v(H2)=0.006mol·L-1·min-1,错误;C、增大c(H2),只能增大CO的转化率,而氢气的转化率降低,错误;D、由所给数据可计算500℃时的化学平衡常数,所以已知CO和H2的物质的量可以计算出反应达平衡后甲醇的浓度,正确,答案选D。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
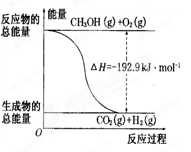
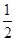 Cl2(g)===NaCl(s) ΔH1
Cl2(g)===NaCl(s) ΔH1 CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1 CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。


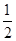 O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1