题目内容
黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取2.000g样品在空气中充分灼烧(假设杂质不参加反应),将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.3360mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4溶液25.00mL。
已知:①4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
②SO2+2Fe3++2H2O→SO42-+2Fe2++4H+
③MnO4-+5Fe2++8H+→Mn2++5Fe3++4H2O
(1)样品中FeS2的质量分数是 。(用小数表示,保留三位,下同)
(2)煅烧1000 t该黄铁矿生产出997.9 t硫酸铵,若黄铁矿制取硫酸时的利用率为0.800,则在制取硫酸铵时硫酸的利用率为 。
(3)为使黄铁矿充分燃烧,工业上使用过量空气(设空气中O2的体积分数为0.200),当空气过量20%时,煅烧后气体中SO2的体积分数是多少?
(4)若接触室导出的气体中含体积分数为0.0672的SO3。把出口气体送进吸收塔,用质量分数为0.980的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为0.200的SO3)。计算吸收106 m3出口气体(已折算为标准状况)所需要质量分数为0.980的硫酸的质量。
已知:①4FeS2+11O2
 2Fe2O3+8SO2
2Fe2O3+8SO2②SO2+2Fe3++2H2O→SO42-+2Fe2++4H+
③MnO4-+5Fe2++8H+→Mn2++5Fe3++4H2O
(1)样品中FeS2的质量分数是 。(用小数表示,保留三位,下同)
(2)煅烧1000 t该黄铁矿生产出997.9 t硫酸铵,若黄铁矿制取硫酸时的利用率为0.800,则在制取硫酸铵时硫酸的利用率为 。
(3)为使黄铁矿充分燃烧,工业上使用过量空气(设空气中O2的体积分数为0.200),当空气过量20%时,煅烧后气体中SO2的体积分数是多少?
(4)若接触室导出的气体中含体积分数为0.0672的SO3。把出口气体送进吸收塔,用质量分数为0.980的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为0.200的SO3)。计算吸收106 m3出口气体(已折算为标准状况)所需要质量分数为0.980的硫酸的质量。
(1)0.630 (2)0.900 (3)0.127 (4)664.6 t
试题分析:
(1)由方程式得关系式为5FeS2~10SO2~20Fe2+~4MnO4-.n(KMnO4)= 0.3360mol/L×0.025L=0.0084mol,所以n(FeS2)= (5÷4)×0.0084mol=0.0105mol。m(FeS2)= 0.0105mol×120g/mol=1.26g.样品中FeS2的质量分数是1.26g÷2.000g=0.630.
(2)1000 t该黄铁矿含纯净物的物质的量为(1000 t×0.630×106g/t)÷120g/mol×2=5.25×106mol.假设在制取硫酸铵时硫酸的利用率为X,则根据S元素守恒可得:5.25×106mol×0.800×X×2="(997.9" t×106g/t)÷132g/mol。解得X=0.900。
(3)假设有4mol的FeS2发生反应,根据方程式4FeS2+11O2
 2Fe2O3+8SO2可知产生了8mol 的SO2需要消耗11mol O2,因为空气中O2的体积分数为0.200,所以需要空气的物质的量为11mol÷0.200="55mol," 若空气过量20%,则实际通入的空气的物质的量为55mol×120%=66mol.由方程式可知若有11mol O2参加反应,由反应前到反应后气体的物质的量减少3mol.所以反应后气体的总物质的量为66-3=63mol.对于气体来说,气体的体积比就是它们的物质的量的比。所以煅烧后气体中SO2的体积分数是8mol÷63mol=0.127.
2Fe2O3+8SO2可知产生了8mol 的SO2需要消耗11mol O2,因为空气中O2的体积分数为0.200,所以需要空气的物质的量为11mol÷0.200="55mol," 若空气过量20%,则实际通入的空气的物质的量为55mol×120%=66mol.由方程式可知若有11mol O2参加反应,由反应前到反应后气体的物质的量减少3mol.所以反应后气体的总物质的量为66-3=63mol.对于气体来说,气体的体积比就是它们的物质的量的比。所以煅烧后气体中SO2的体积分数是8mol÷63mol=0.127.(4)假设需要质量分数为0.980的硫酸的质量为X,其中硫酸的物质的量为0.980X÷98=0.010X,水的物质的量为0.020X÷18=0.0011X。则通入SO3气体发生反应:H2O+SO3=H2SO4产生的硫酸消耗的SO3的物质的量为0.0011X。106 m3出口气体SO3的物质的量为:n(SO3)="(" 0.0672×106 m3×103L/m3) ÷22.4 L/mol= 3×106 mol.,那么得到的得到“发烟H2SO4”中含有SO3的物质的量为(3×106-0.0011x)mol. 由于得到“发烟H2SO4”中含质量分数为0.200的SO3。所以(3×106-0.0011x)mol×80g/mol÷(x+3×106mol×80g/mol)=0.2.解得x=664.6×106g=664.6 t。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2Cu+O2↑+4H+
2Cu+O2↑+4H+ mol·L-1
mol·L-1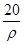 mol·L-1
mol·L-1 mol·L-1
mol·L-1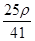 mol·L-1
mol·L-1