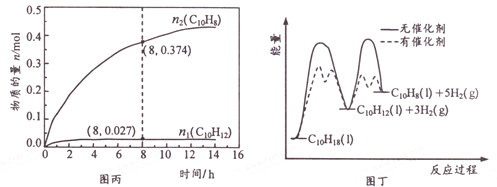
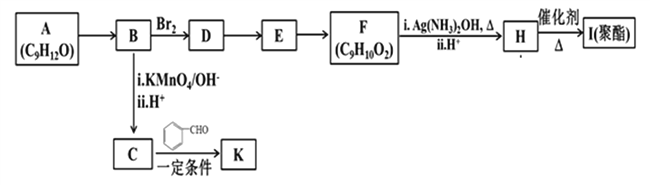
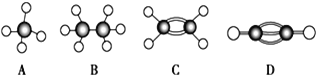
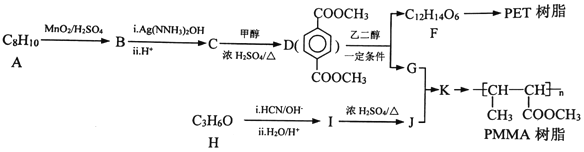
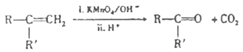题目内容
【题目】【选做-选修3:物质结构与性质】硒化锌是一种半导体材料,回答下列问题。
(1)锌在周期表中的位置_______;Se基态原子价电子排布图为______。元素锌、硫和硒第一电离能较大的是________(填元素符号)。
(2)Na2SeO3分子中Se原子的杂化类型为_______;H2SeO4的酸性比H2SeO3强,原因是_______。
(3)气态SeO3分子的立体构型为_______;下列与SeO3互为等电子体的有__(填序号)。
A.CO32- B.NO3- C.NCl3 D.SO32-
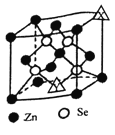
(4)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为______(填元素符号);该晶胞中硒原子所处空隙类型为_____(填“立方体”、“正四面体”或正八面体”);若该品晶胞密度为ρg/cm3,硒化锌的摩尔质量为Mg/mol。用NA代表阿伏加德罗常数的数值,则晶胞参数a为_______nm。
【答案】 第四周期IIB族 ![]() S sp3 H2SeO4的非羟基氧比H2SeO3多(或H2SeO4中Se的化合价更高) 平面三角形 AB Zn 正四面体
S sp3 H2SeO4的非羟基氧比H2SeO3多(或H2SeO4中Se的化合价更高) 平面三角形 AB Zn 正四面体 ![]()
【解析】(1)Zn锌的原子序数是30,其电子排布式为1S22S22P63S23P63d104S2,在周期表中的位置第四周期IIB族;Se原子序数是34,原子核外有34个电子,最外层电子排布式为4S24P6,基态原子价电子排布图为![]() 。元素锌金属性较强,第一电离能较小,硫和硒为同主族元素,同主族元素由上到下非金属性逐渐减弱,所以硫的非金属性强于Se,所以第一电离最大的是S。
。元素锌金属性较强,第一电离能较小,硫和硒为同主族元素,同主族元素由上到下非金属性逐渐减弱,所以硫的非金属性强于Se,所以第一电离最大的是S。
(2) Na2SeO3分子中Se原子的价电子对数为;(6+2)/2=4,所以Se原子的杂化类型为sp3;H2SeO4的非羟基氧比H2SeO3多(或H2SeO4中Se 的化合价更高),所以H2SeO4酸性比H2SeO3 强;答案:sp3 . H2SeO4的非羟基氧比H2SeO3多(或H2SeO4中Se 的化合价更高) 。
(3)气态SeO3分子的价层电子对数为3,Se没有孤对电子,故分子的立体构型为平面三角形;等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的离子由有A.CO32-、B.NO3-。答案:AB。
(4)硒化锌的晶胞结构中原子个数比为1;1,其中Se原子4个,若X和Y点所堆积的原子均为锌原子,则8![]() +6
+6![]() 1/2=4,符合;则图中X和Y点所堆积的原子均为Zn原子,根据图中原子的位置可知,该晶胞中硒原子所处空隙类型为正四面体;若该品晶胞密度为ρg/cm3,硒化锌的摩尔质量为Mg/mol。用NA代表阿伏加德罗常数的数值,根据p=m/v=4M/(NA.V),则V=4M/PnA,则晶胞的边长为a为
1/2=4,符合;则图中X和Y点所堆积的原子均为Zn原子,根据图中原子的位置可知,该晶胞中硒原子所处空隙类型为正四面体;若该品晶胞密度为ρg/cm3,硒化锌的摩尔质量为Mg/mol。用NA代表阿伏加德罗常数的数值,根据p=m/v=4M/(NA.V),则V=4M/PnA,则晶胞的边长为a为![]() nm。
nm。