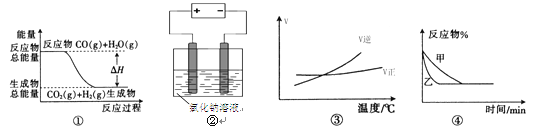
题目内容
【题目】下列解释实验事实的方程式书写不正确的是
选项 | 事实 | 解释 |
A | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色 | 2AgCl+S2 =Ag2S+2Cl |
B | 将水蒸气通过灼热的铁粉,产生可燃性气体 | 2Fe+3H2O(g) |
C | 向澄清石灰水中滴加少量小苏打溶液,产生白色沉淀 | Ca2++OH+HCO3 = CaCO3↓+H2O |
D | 将Cl2通入KBr溶液,无色溶液变黄色 | Cl2+2Br = 2Cl+Br2 |
A.AB.BC.CD.D
【答案】B
【解析】
A. 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,生成Ag2S,AgCl、Ag2S均为难溶性固体,不能拆,故离子方程式书写正确,故A正确;
B. 将水蒸气通过灼热的铁粉,产生可燃性气体为氢气,还生成Fe3O4,正确的化学方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2,故B错误;
Fe3O4+4H2,故B错误;
C. 向澄清石灰水中滴加少量小苏打溶液,产生白色沉淀,假设小苏打为1mol,则碳酸氢根为1mol,消耗1mol氢氧根离子,生成1mol碳酸根离子和1mol水,1mol碳酸根离子再结合1mol钙离子生成1mol碳酸钙沉淀,故离子方程式书写正确,故C正确;
D. 将Cl2通入KBr溶液,无色溶液变黄色,Cl2氧化Br-生成溴单质,本身被还原为氯离子,故离子方程式书写正确,故D正确;
故选B。

【题目】二甲醚(CH3OCH3)是无色气体,是柴油的理想替代燃料。清华大学王志良等研究了,由合成气(组成为H2、CO和少量的CO2)一步法制备二甲醚的问题,其中的主要过程包括以下三个反应:
(i)CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1 kJ/mol
CH3OH(g) △H1=-90.1 kJ/mol
(ii)CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.1 kJ/mol
CO2(g)+H2(g) △H2=-41.1 kJ/mol
(iii)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3=-24.5 kJ/mol
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ/mol
(1)由H2和CO制备二甲醚(另一产物为CO2)的热化学方程式为________。
(2)合成气初始组成为n(H2):n(CO):n(CO2)=0.67:0.32:0.01的反应体系。在250℃和5.0 MPa条件下,在1 L密闭容器中经10 min达到化学平衡时,各组分的物质的量如下表:
成分 | H2 | CO | H2O | CH3OH | CH3OCH3 |
物质的量(mol) | 0.26 | 0.01 | 0.04 | 0.02 | 0.11 |
则反应(iii)在该条件下的平衡常数是_______;在反应进行的10 min内,用CH3OH表示的反应(i)的平均速率是_______。
(3)课题组探究了外界条件,对合成气单独合成甲醇反应体系和直接合成二甲醚反应体系的影响。
①图1和图2显示了温度250 ℃和5.0 MPa条件下,合成气组成不同时,反应达到平衡时的情况。(图中M代表甲醇、D代表二甲醚、D+M代表甲醇和二甲醚。下同)
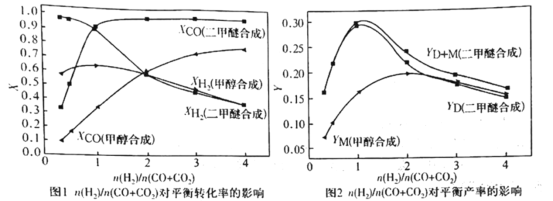
由图可知,随着合成气中H2所占比例的提高,合成甲醇的反应体系中,CO转化率的变化趋势是______。对于由合成气直接合成二甲醚的反应体系,为了提高原料转化率和产品产率,![]() 的值应控制在_____附近。
的值应控制在_____附近。
②在压强为5.0MPa、![]() =2.0及
=2.0及![]() 的条件下,反应温度对平衡转化率和产率的影响如图3和图4所示。
的条件下,反应温度对平衡转化率和产率的影响如图3和图4所示。
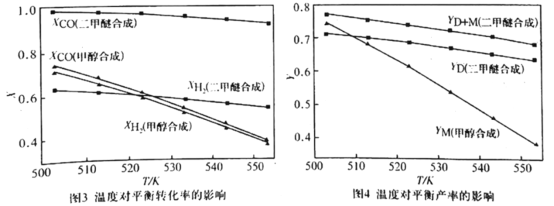
课题组认为图3所示的各反应物的转化率变化趋势符合反应特点,其理由是______。图中显示合成气直接合成二甲醚体系中,CO的转化率明显高于H2的转化率,原因是_______。图4显示随着温度增大,合成气单独合成甲醇时的产率,要比合成气直接合成二甲醚时的产率减小的快,原因是_______。