题目内容
【题目】二甲醚(CH3OCH3)是无色气体,是柴油的理想替代燃料。清华大学王志良等研究了,由合成气(组成为H2、CO和少量的CO2)一步法制备二甲醚的问题,其中的主要过程包括以下三个反应:
(i)CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1 kJ/mol
CH3OH(g) △H1=-90.1 kJ/mol
(ii)CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.1 kJ/mol
CO2(g)+H2(g) △H2=-41.1 kJ/mol
(iii)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3=-24.5 kJ/mol
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ/mol
(1)由H2和CO制备二甲醚(另一产物为CO2)的热化学方程式为________。
(2)合成气初始组成为n(H2):n(CO):n(CO2)=0.67:0.32:0.01的反应体系。在250℃和5.0 MPa条件下,在1 L密闭容器中经10 min达到化学平衡时,各组分的物质的量如下表:
成分 | H2 | CO | H2O | CH3OH | CH3OCH3 |
物质的量(mol) | 0.26 | 0.01 | 0.04 | 0.02 | 0.11 |
则反应(iii)在该条件下的平衡常数是_______;在反应进行的10 min内,用CH3OH表示的反应(i)的平均速率是_______。
(3)课题组探究了外界条件,对合成气单独合成甲醇反应体系和直接合成二甲醚反应体系的影响。
①图1和图2显示了温度250 ℃和5.0 MPa条件下,合成气组成不同时,反应达到平衡时的情况。(图中M代表甲醇、D代表二甲醚、D+M代表甲醇和二甲醚。下同)
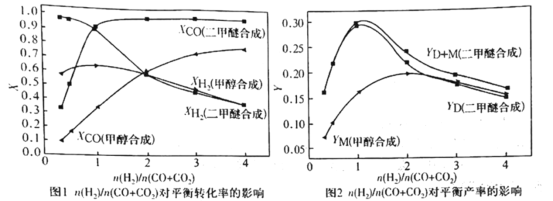
由图可知,随着合成气中H2所占比例的提高,合成甲醇的反应体系中,CO转化率的变化趋势是______。对于由合成气直接合成二甲醚的反应体系,为了提高原料转化率和产品产率,![]() 的值应控制在_____附近。
的值应控制在_____附近。
②在压强为5.0MPa、![]() =2.0及
=2.0及![]() 的条件下,反应温度对平衡转化率和产率的影响如图3和图4所示。
的条件下,反应温度对平衡转化率和产率的影响如图3和图4所示。
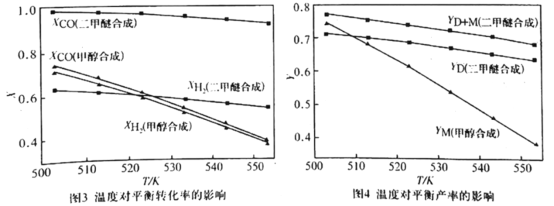
课题组认为图3所示的各反应物的转化率变化趋势符合反应特点,其理由是______。图中显示合成气直接合成二甲醚体系中,CO的转化率明显高于H2的转化率,原因是_______。图4显示随着温度增大,合成气单独合成甲醇时的产率,要比合成气直接合成二甲醚时的产率减小的快,原因是_______。
【答案】3CO(g)+3H2(g)=CO2(g)+CH3OCH3(g) △H=-245.8 kJ/mol 11 0.024 mol/(L·min) 由小逐渐变大 1 反应体系中的所有反应均为放热反应 反应(ii)有H2生成 反应(i)的焓变大于反应(iii)的焓变
【解析】
(1)根据盖斯定律,将已知热化学方程式叠加,可得待求反应的热化学方程式;
(2)将平衡时各种物质的浓度带入平衡常数表达式可得反应(iii)可得K的值;先计算(i)开始产生甲醇的浓度,再根据化学反应速率的定义计算(i)的化学反应速率v(CH3OH);
(3)①根据图1中H2的含量与转化率关系分析判断;结合图1、图2分析判断![]() 的取值范围;
的取值范围;
②根据温度对化学平衡移动的影响分析;根据反应(ii)中有H2生成,从物质浓度对化学平衡移动的影响分析解答;根据反应焓变大小判断产率减小的原因。
(1)已知:(i)CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1 kJ/mol
CH3OH(g) △H1=-90.1 kJ/mol
(ii)CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.1 kJ/mol
CO2(g)+H2(g) △H2=-41.1 kJ/mol
(iii)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3=-24.5 kJ/mol
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ/mol
根据盖斯定律,将(i)×1+(ii)+ (iii),整理可得:3CO(g)+3H2(g)=CO2(g)+CH3OCH3(g) △H=-245.8 kJ/mol;
(2)对于2CH3OH(g)![]() CH3OCH3(g)+H2O(g),由于容器的容积是1 L,所以平衡时各种物质的浓度与其物质的量在数值上相等,平衡时c(CH3OH)=0.02 mol/L,c(CH3OCH3)=0.11 moll/L,c(H2O)=0.04 mol/L,故其平衡常数K=
CH3OCH3(g)+H2O(g),由于容器的容积是1 L,所以平衡时各种物质的浓度与其物质的量在数值上相等,平衡时c(CH3OH)=0.02 mol/L,c(CH3OCH3)=0.11 moll/L,c(H2O)=0.04 mol/L,故其平衡常数K=![]() =11;
=11;
对于反应(i),开始时从正反应方向开始,c(CH3OH)=0 mol/L,10 min时c(CH3OCH3)=0.11 moll/L,则发生反应(iii)消耗甲醇的浓度是c(CH3OH)=0.11 mol/L×2=0.22 mol/L,此时还有 c(CH3OH)=0.02 mol/L,则反应(i)产生甲醇的浓度是c(CH3OH)总=0.22 mol/L+0.02 mol/L=0.24 mol/L,故用甲醇表示的反应速率v(CH3OH)=![]() =0.024 mol/(L·min);
=0.024 mol/(L·min);
(3)①根据图1可知:在合成甲醇的反应体系中,随着合成气中H2所占比例的提高,CO转化率的变化趋势是由小逐渐变大;
根据图1可知:在合成二甲醚的反应体系中,随着合成气中H2所占比例的提高,CO转化率的变化趋势是由小逐渐变大,当![]() =1时达到最大值,此后几乎不再发生变化;根据图2可知:在
=1时达到最大值,此后几乎不再发生变化;根据图2可知:在![]() =1时二甲醚的产率达到最大值,此后随着
=1时二甲醚的产率达到最大值,此后随着![]() 的增大,产品产率又逐渐变小,故为了提高原料转化率和产品产率,
的增大,产品产率又逐渐变小,故为了提高原料转化率和产品产率,![]() 的值应控制在1附近;
的值应控制在1附近;
②根据图示可知:在![]() 不变时,随着温度的升高,各个反应平衡转化率降低,这是由于反应体系中的所有反应均为放热反应,升高温度,平衡向吸热的逆反应方向移动,导致平衡时产生的物质相应的量减小;图中显示合成气直接合成二甲醚体系中,CO的转化率明显高于H2的转化率,原因是反应(ii) CO(g)+H2O(g)
不变时,随着温度的升高,各个反应平衡转化率降低,这是由于反应体系中的所有反应均为放热反应,升高温度,平衡向吸热的逆反应方向移动,导致平衡时产生的物质相应的量减小;图中显示合成气直接合成二甲醚体系中,CO的转化率明显高于H2的转化率,原因是反应(ii) CO(g)+H2O(g)![]() CO2(g)+H2(g)中有H2生成,增大了反应物H2的浓度,平衡正向移动,因而可提高另一种反应物CO的转化率;根据图4显示:随着温度增大,合成气单独合成甲醇时的产率,要比合成气直接合成二甲醚时的产率减小的快,原因是反应(i)的焓变大于反应(iii)的焓变,平衡逆向移动消耗的多,故物质二甲醚转化率降低的多。
CO2(g)+H2(g)中有H2生成,增大了反应物H2的浓度,平衡正向移动,因而可提高另一种反应物CO的转化率;根据图4显示:随着温度增大,合成气单独合成甲醇时的产率,要比合成气直接合成二甲醚时的产率减小的快,原因是反应(i)的焓变大于反应(iii)的焓变,平衡逆向移动消耗的多,故物质二甲醚转化率降低的多。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】下列解释实验事实的方程式书写不正确的是
选项 | 事实 | 解释 |
A | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色 | 2AgCl+S2 =Ag2S+2Cl |
B | 将水蒸气通过灼热的铁粉,产生可燃性气体 | 2Fe+3H2O(g) |
C | 向澄清石灰水中滴加少量小苏打溶液,产生白色沉淀 | Ca2++OH+HCO3 = CaCO3↓+H2O |
D | 将Cl2通入KBr溶液,无色溶液变黄色 | Cl2+2Br = 2Cl+Br2 |
A.AB.BC.CD.D