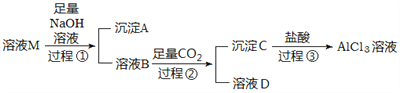
题目内容
【题目】下列微粒在所给条件下,一定可以大量共存的是
A. 酸性溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B. 遇酚酞显红色的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C. 与铝反应能产生大量氢气的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D. 透明溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
【答案】A
【解析】
A.Fe2+、Al3+、SO42、NH4+之间不反应,且都不与氢离子反应,在酸性溶液中能够大量共存,故A符合题意;
B.该溶液中存在大量氢氧根离子,Cl2、I之间发生氧化还原反应,Mg2+与氢氧根离子反应,Cl2与氢氧根离子之间发生氧化还原反应,在溶液中不能大量共存,故B不符合题意;
C.该溶液呈酸性或强碱性,HCO3能与氢离子或氢氧根离子反应,CH3COO与氢离子发生反应生成弱电解质醋酸,在溶液中一定不能大量共存,故C不符合题意;
D.铁离子和氢氧根反应生成难溶物氢氧化铁,铁离子和碳酸氢根会发生相互促进的双水解而生成难溶物氢氧化铁和二氧化碳,氢氧根和碳酸氢根会发生离子反应,在溶液中一定不能大量共存,故D不符合题意,答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】在一定温度下、1L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示,下列有关说法正确的是
x | y | w | |
n(起始)/mol | 2 | l | 0 |
n(平衡)/mol | l | 0.5 | 1.5 |
A. 该温度下,此反应的平衡常数表达式是![]()
B. 升高温度,若w的体积分数减小,则此反应ΔH>0
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向容器中通入3molw,达到平衡时,n(x)=2mol
【题目】氨作为重要化工原料,被大量应用于工业生产。氨在不同催化剂条件下可发生下列两个反应:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H=-1266.6kJ·molˉ1
2N2(g) +6H2O(g) △H=-1266.6kJ·molˉ1
(1)写出NO分解生成N2与O2的热化学方程式:___________________________。
(2)反应I在容积固定的密闭容器中进行,容器内部分物质的物质的量浓度如下表:
时间 浓度 | c(NH3)/mol/Ll | c((O2)/mol/L | c(NO)/ mol/L |
第 0 min | 0.8 | 1.6 | 0 |
第 2 min | 0.3 | 0.975 | 0.5 |
第 3 niin | 0.3 | 0.975 | 0.5 |
第4 min | 0.7 | 1.475 | 0.1 |
①反应从开始到第2min时,v(H2O)=__________________。
②在第3min时,改变的反应条件可能是_________(填选项字母)。
A.使用催化剂 B.臧小压强 C.升高温度 D.增加O2的浓度
③该反应达到平衡状态的标志是___________(填选项字母)。
A.在恒温恒容的容器中,混合气体的密度不再变化
B.单位时间内消耗nmolNO的同时消耗nmolNH3
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
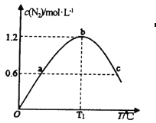
(3)①若在容积为2L的密闭容器中充入8molNH3(g)和6molO2(g),发生反应II。保持其他条件不变,在相同时间内测得c(N2)与温度的关系如图所示。则T1℃下,NH3的平衡转化率为___。
②图中a、c两点对应的容器内部压强Pa____Pc(填“>”、“<”或“=”)
(4)氨气可用于生成硝酸铵化肥。25℃时,已知NH3·H2O的电离常数Kb=1.8×10-5,则硝酸铵在此温度下发生水解反应的平衡常数Kh=___________。