题目内容
密度为1.45g/cm3的硫酸溶液中,逐滴加入BaCl2溶液,直到沉淀完全为止,已知沉淀的质量与原硫酸溶液相等,则原硫酸溶液的浓度为 ( )
| A.29.6% | B.42.1% | C.14.8mol/L | D.8mol/L |
B
反应的化学方程式为:H2SO4 + BaCL2===== BaSO4 + 2H2O;设生成的硫酸钡为1mol;即原硫酸溶液的质量为233g,则原硫酸溶液的体积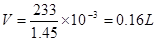 ,根据硫酸根离子守恒可知原硫酸溶液中硫酸的物质的量为1mol;所以原硫酸溶液的浓度为
,根据硫酸根离子守恒可知原硫酸溶液中硫酸的物质的量为1mol;所以原硫酸溶液的浓度为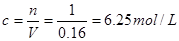 ;
;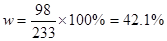
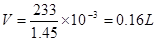 ,根据硫酸根离子守恒可知原硫酸溶液中硫酸的物质的量为1mol;所以原硫酸溶液的浓度为
,根据硫酸根离子守恒可知原硫酸溶液中硫酸的物质的量为1mol;所以原硫酸溶液的浓度为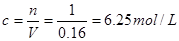 ;
;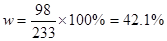

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目