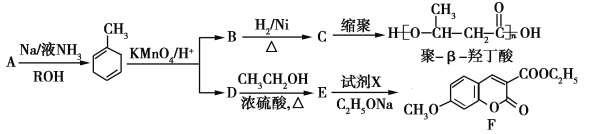
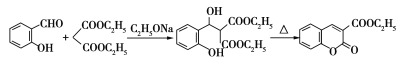
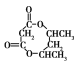
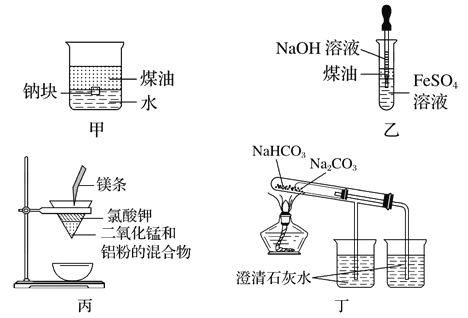
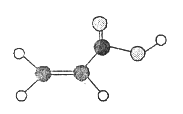
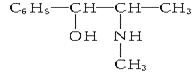
题目内容
【题目】某厂从废催化剂(主要含Pt、Al2O3、石墨等)中回收海绵铂和硫酸铝晶体。工艺流程如下:
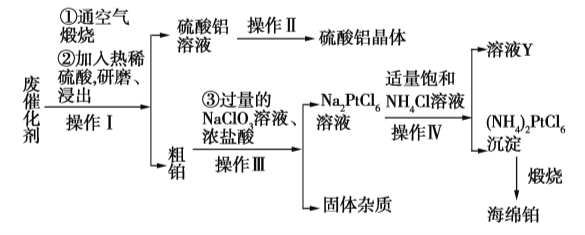
请回答下列问题:
(1)第①步通入空气煅烧的目的是_____________________________。
(2)第②步用热酸研磨浸出而不是直接浸出的原因是_____________________________。
(3)写出第③步反应的离子方程式:_____________________________。
(4)此流程中的四个操作中有三个是相同的,其名称是__________,在实验室进行此操作使用的主要玻璃仪器有___________________。溶液Y中可以循环使用的物质是____________(填化学式)。
(5)用返滴定法测定硫酸铝晶体中铝的含量:称取硫酸铝晶体0.5400 g,用2.0 mL 3.0 mol·L1的硫酸溶解后制成250 mL溶液,取25.00 mL于锥形瓶中,加入0.02 mol·L1的EDTA标准液20.00 mL和缓冲溶液,加热5 min,冷却至室温,加2滴二甲酚橙指示剂,用0.02 mol·L1的标准ZnSO4溶液滴定至终点消耗5.00 mL。则该晶体中铝的质量分数为___________。(已知Al3+、Zn2+与EDTA反应的方程式如下:Al3++H2Y2![]() AlY+2H+,H2Y2+Zn2+
AlY+2H+,H2Y2+Zn2+![]() ZnY2+2H+)
ZnY2+2H+)
【答案】(1)除去废催化剂中的石墨(2分)
(2)增大反应物的接触面积,加快浸出速率(2分)
(3)3Pt+2![]() +12H++16Cl
+12H++16Cl![]() 3
3![]() +6H2O(2分)
+6H2O(2分)
(4)过滤(1分) 普通漏斗、烧杯、玻璃棒(3分) NaClO3和HCl(2分)
(5)15%(3分)
【解析】(1)废催化剂(主要含Pt、Al2O3、石墨)中,Pt、Al2O3不会被氧气氧化,而石墨会被氧化成CO2气体而去除,故第①步通入空气煅烧的目的是除去废催化剂中的石墨。
(2)第②步是固液反应,用热酸研磨浸出而不是直接浸出的原因是增大反应物的接触面积,加快浸出速率。
(3)根据流程图可判断反应产物中有Na2PtCl6,再根据氧化还原反应规律,写出该反应的离子方程式:3Pt+2![]() +12H++16Cl
+12H++16Cl![]() 3
3![]() +6H2O。
+6H2O。
(4)此流程中的四个操作中Ⅰ、Ⅲ、Ⅳ都是固液分离,是过滤,在实验室进行过滤操作使用的主要玻璃仪器有普通漏斗、烧杯、玻璃棒。在溶液Y中含有过量的NaClO3溶液和浓盐酸,在第③步可使用。(5)EDTA总物质的量为0.0004 mol,与Zn2+反应的EDTA物质的量为0.0001 mol,与Al3+反应的EDTA物质的量为0.0003 mol,故0.5400 g硫酸铝晶体中含铝物质的量为0.0003×10 mol,质量为0.0003 mol× 27 g·mol1×10=0.081 g,故ω(Al)=![]() ×100%=15%。
×100%=15%。

【题目】煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分。
(1)已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:________________________________________________________________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度/℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH________(填“>”、“=”或“<”)0。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,4 min达到平衡时测得c(CO)=0.2 mol·L-1,此时的温度为_____,则反应速率v(H2)=__________。
(3)T ℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的
CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的![]() ,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)。__________
,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)。__________
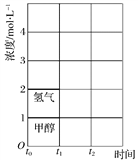
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式:_____________________________________________________。
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
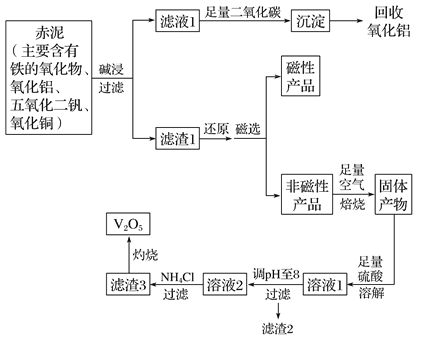
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。