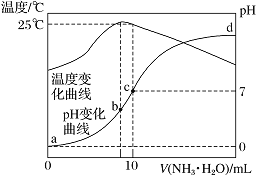
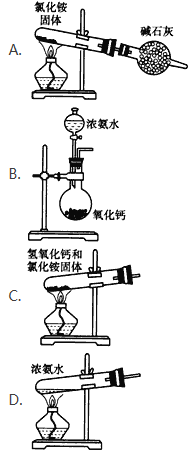
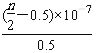题目内容
【题目】设NA为阿伏加德罗常数值。下列说法中正确的是( )
A.122.5 g KClO3中含Cl-数目为NA
B.1 mol·L-l的NaOH溶液中含Na+数目为NA
C.标准状况下,22.4L水中含氢原子数目为2NA
D。常温常压下,32 g SO3中含氧原子数目为1.2NA
【答案】D
【解析】
试题分析:A KClO3=K++ClO3- ; 因此A错误。B正确。B.无体积,不能计算Na+数目,B错误;标准状况下,水为液态,无法计算,因此C错误. D。32 g SO3的物质的量为32/80=0.4mol.含氧原子数目为1.2NA,D正确;

 阅读快车系列答案
阅读快车系列答案【题目】现有部分元素的性质与原子(或分子)结构如下表所示:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
U | 第三周期元素的非金属离子还原性最弱 |
(1)写出元素T含有10个中子的原子符号:_________________。写出X与Y形成的化合物的电子式______________。
(2)Y与Z相比,金属性较强的是________(填元素符号),下列表能证明这一事实的是__________(填字母)。
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质与水反应剧烈
c.Y的化合价比Z低 d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)写出Z与U最高价氧化物对应的水合物相互反应的方程式____________________________
(4)M物质由T、Y、Z三种元素组成,请写出含0.1 mol的M溶液与60mL5 mol·L-1
的盐酸反应的离子反应式________________________________
(5)元素X与氢元素以原子个数比1∶2化合形成常用于火箭燃料的化合物元素T和氢元素以原子个数比为1∶1化合形成化合物Q,Q与W发生氧化还原反应,反应的产物不污染环境,写出该反应的化学方程式:__________________________________。