题目内容
某化学兴趣小组以工业碳酸钙(含少量Al2O3、Fe2O3、SiO2等杂质)生产二水合氯化钙晶体(CaCl2?2H2O)的操作流程为:
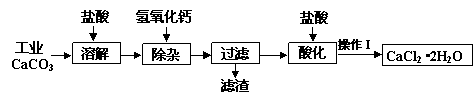
(1)CaCO3与盐酸反应的离子方程式______.
(2)加入氢氧化钙溶液调节溶液的pH为8.0-8.5,此时Al3+、Fe3+沉淀完全,则滤渣主要成分的化学式为______,若用氢氧化钠溶液除杂则产品中可能混有的物质为______.
(3)酸化时加盐酸将溶液的pH调节到4.0左右,其主要目的是______.
(4)操作Ⅰ中应包括①蒸发浓缩②冷却结晶③过滤④______⑤______等实验步骤.
(5)为测定样品中CaCl2?2H2O的含量,称取7.350g样品配成200.0mL溶液,与205.0mL0.5000mol/LAgNO3溶液恰好完全反应.
①样品中CaCl2?2H2O的质量分数为______.
②若计算出结果有明显偏差,你认为在操作Ⅰ的五个步骤中由______引起的(填序号),理由是______.

(1)CaCO3与盐酸反应的离子方程式______.
(2)加入氢氧化钙溶液调节溶液的pH为8.0-8.5,此时Al3+、Fe3+沉淀完全,则滤渣主要成分的化学式为______,若用氢氧化钠溶液除杂则产品中可能混有的物质为______.
(3)酸化时加盐酸将溶液的pH调节到4.0左右,其主要目的是______.
(4)操作Ⅰ中应包括①蒸发浓缩②冷却结晶③过滤④______⑤______等实验步骤.
(5)为测定样品中CaCl2?2H2O的含量,称取7.350g样品配成200.0mL溶液,与205.0mL0.5000mol/LAgNO3溶液恰好完全反应.
①样品中CaCl2?2H2O的质量分数为______.
②若计算出结果有明显偏差,你认为在操作Ⅰ的五个步骤中由______引起的(填序号),理由是______.
(1)碳酸钙与盐酸的反应的方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑,离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(2)加入氢氧化钙溶液调节溶液的pH为8.0-8.5,此时Al3+、Fe3+沉淀完全,形成氢氧化铝和氢氧化铁沉淀,此时二氧化硅也不会发生反应,若用氢氧化钠溶液除杂,则氢氧化钠会和盐酸反应生成氯化钠,作为杂质混入产品中,故答案为:Al(OH)3、SiO2、Fe(OH)3;NaCl;
(3)酸化时加盐酸将溶液的pH调节到4.0左右,可以将沉淀铁离子以及铝离子而加入的氢氧化钙中和,故答案为:除去过量的氢氧化钙;
(4)氯化钙溶液获得氯化钙晶体的方法:蒸发浓缩,冷却结晶,过滤,洗涤,干燥,故答案为:洗涤;干燥;
(5)①氯化钙溶液和硝酸银反应的实质是氯离子和银离子之间的反应,根据氯元素守恒,即CaCl2~2AgNO3,设和硝酸银反应的氯化钙的物质的量是x,
CaCl2 ~2AgNO3~2AgCl
1 2
x0.205L×0.5000mol/L
=
解得x=0.05125mol,样品中CaCl2?2H2O的质量分数为
×100%=102.5%,故答案为:102.5%;
②对氯化钙晶体加热使之失去结晶水操作中,干燥温度过高时CaCl2?2H2O晶体失去部分结晶水,会给实验带来误差,故答案为:⑤;干燥温度过高时CaCl2?2H2O晶体失去部分结晶水.
(2)加入氢氧化钙溶液调节溶液的pH为8.0-8.5,此时Al3+、Fe3+沉淀完全,形成氢氧化铝和氢氧化铁沉淀,此时二氧化硅也不会发生反应,若用氢氧化钠溶液除杂,则氢氧化钠会和盐酸反应生成氯化钠,作为杂质混入产品中,故答案为:Al(OH)3、SiO2、Fe(OH)3;NaCl;
(3)酸化时加盐酸将溶液的pH调节到4.0左右,可以将沉淀铁离子以及铝离子而加入的氢氧化钙中和,故答案为:除去过量的氢氧化钙;
(4)氯化钙溶液获得氯化钙晶体的方法:蒸发浓缩,冷却结晶,过滤,洗涤,干燥,故答案为:洗涤;干燥;
(5)①氯化钙溶液和硝酸银反应的实质是氯离子和银离子之间的反应,根据氯元素守恒,即CaCl2~2AgNO3,设和硝酸银反应的氯化钙的物质的量是x,
CaCl2 ~2AgNO3~2AgCl
1 2
x0.205L×0.5000mol/L
| 1 |
| x |
| 2 |
| 0.2050×0.5000 |
解得x=0.05125mol,样品中CaCl2?2H2O的质量分数为
| 0.05125×147 |
| 7.350 |
②对氯化钙晶体加热使之失去结晶水操作中,干燥温度过高时CaCl2?2H2O晶体失去部分结晶水,会给实验带来误差,故答案为:⑤;干燥温度过高时CaCl2?2H2O晶体失去部分结晶水.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目