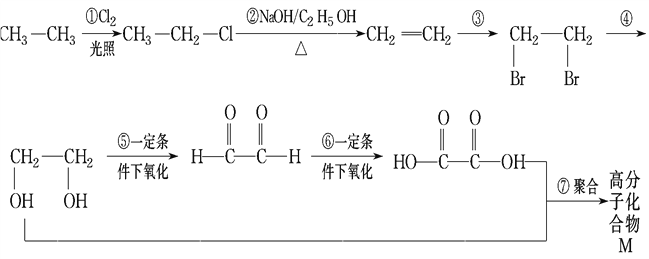
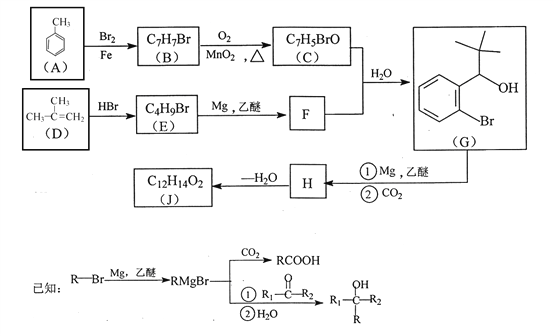
��Ŀ����
����Ŀ����ͼ��ʾ��ijͬѧ���һ������(CH3OCH3)ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ��
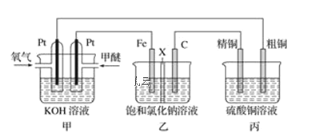
(1)ͨ�������ĵ缫Ϊ________����д�������缫��Ӧʽ____________________��
(2)���缫Ϊ________����ʯī�缫(C)�ĵ缫��ӦʽΪ____________________��
(3)��Ӧһ��ʱ�����װ��������NaOH��Ҫ��_____����(��缫����)��
(4)�����ͭ�к���п���������ʣ���װ���������ϵ缫��ӦʽΪ___________��___________����Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ�________(����������������С������������)��
���𰸡��� CH3OCH3��12e����16OH��=2CO32����11H2O �� 2Cl����2e��=Cl2�� �� Zn��2e��=Zn2�� Cu��2e��=Cu2�� ��С
��������
���������ͼʾ����Ϊԭ��أ��Һͱ�Ϊ���أ�ȼ�ϵ����Ͷ��ȼ�ϵĵ缫�Ǹ�����Ͷ���������ĵ缫�����������ͨ����ѵ�Ϊ�������������������о�ͭΪ������ͨ��������Ϊ�����������е�C�缫�����еĴ�ͭΪ���������ԭ��غ͵���ԭ���������
(1)ȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ԭ��أ�Ͷ��ȼ�ϵĵ缫�Ǹ�����Ͷ���������ĵ缫������������ͨ�������ĵ缫�������������ϼ���ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦʽΪ��CH3OCH3-12e-+16OH-�T2CO32-+11H2O���ʴ�Ϊ������CH3OCH3-12e-+16OH-�T2CO32-+11H2O��
(2)�ҳ�����ӵ�Դ���ڵ��أ����缫����ԭ��صĸ�������������������ʯī�缫�������������������ӷŵ������������缫��ӦʽΪ��2Cl--2e-�TCl2�����ʴ�Ϊ������2Cl--2e-�TCl2����
(3)�ҳ�������������������̼�������������ӷŵ����������������������ӷŵ磬����������������������Ũ�ȴ���������Ũ����Һ�ʼ��ԣ�������װ������������������Ҫ�����������ʴ�Ϊ������
(4)�����ͭ�к���п���������ʣ������ϲ���ͭ���б�Cu���õ�пʧ���ӽ�����Һ������������ͭ�������缫��ӦʽΪZn-2e-=Zn2+��Cu-2e-=Cu2+������ת�Ƶ��������֪���������ܽ��ͭС��������������ͭ�����Է�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ���С���ʴ�Ϊ��Zn-2e-=Zn2+��Cu-2e-=Cu2+����С��

 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д�����Ŀ��һ���¶�ʱ����2.0 L�����ܱ������г���2 mol SO2��1 mol O2��������Ӧ��2SO2(g)��O2(g)![]() 2SO3(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
2SO3(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
t / s | 0 | 2 | 4 | 6 | 8 |
n(SO3) / mol | 0 | 0��8 | 1��4 | 1.8 | 1.8 |
����˵����ȷ����( )
A. ��Ӧ��ǰ2 s ��ƽ������v(O2) �� 0��4 mol��L��1��s��1
B. ���������������䣬���ѹ����1.0 L��ƽ�ⳣ��������
C. ��ͬ�¶��£���ʼʱ�������г���4 mol SO3���ﵽƽ��ʱ��SO3��ת����С��10%
D. �����¶Ȳ��䣬����������ٳ���2 mol SO2��1 mol O2����Ӧ�ﵽ��ƽ��ʱn(SO3)/n(O2)��С