题目内容
【题目】某研究性小组借助A-D的仪器装置完成有关实验。
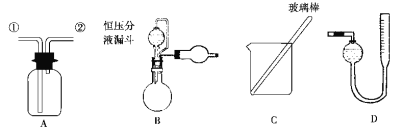
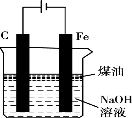
为了探究镀锌薄铁板上的锌的质量分数ω(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH===Na2ZnO2+H2↑。据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(1)选用B和_____________(填仪器标号)两个装置进行实验。
(2)测得充分反应后生成氢气的体积为VL(标准状况),ω(Zn)=_____________。
(3)计算镀层厚度,还需要检索的一个物理量是_____________。
(4)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将_____________(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g。
(5)ω(Zn)=____________。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(6)从实验误差角度分析,方案丙__________方案乙( “优于”、“劣于”或“等同于”)。
【答案】(1)D(2)![]() (3)金属锌的密度(4)偏大(5)
(3)金属锌的密度(4)偏大(5)![]() (6)劣于
(6)劣于
【解析】
试题分析:(1)方案甲:Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,依据反应方程式即可算出Zn的质量分数,所以需要的装置有测氢气体积的D装置,答案选D。
(2)Zn与氢气之间物质的量之比为1:1,则n(Zn)=![]() ,
,
所以w(Zn)=![]() 。
。
(3)有了Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积,即可求出Zn的高度(厚度)。
(4)恒压式分液漏斗产生的气体有部分残留在分液漏斗上方,故排气时收集少了,所以用普通漏斗时收集的氢气多一些,因此计算出的Zn的量偏大。
(5)减少的质量即为Zn的质量,减少的质量为m1g-m2g,则ω(Zn)=![]() 。
。
(6)丙方案根据氢气的质量差值,显然误差大,因为产生的氢气质量很小,计算偏差大。

【题目】
(1)某同学用托盘天平称量锌粒24.4g(1g以下用游码),他把锌粒放在右盘,砝码放在左盘,当天平平衡时,所称取的锌粒的实际质量应是_______________g
(2)下列一定量的各物质所含原子个数按由小到大的顺序排列的是
①0.5mol氨气 ②标准状况下22.4L二氧化碳 ③4℃时9g水 ④0.2mol硫酸
A.①④③② | B.④③①② | C.②③④① | D.①④②③ |
(3)实验室检验溶液中有无SO42-的方法是:取少量溶液于试管中,先加_____________,后加_____________,如果出现白色沉淀,则证明有SO42-
(4)0.6mol的氧气与0.4mol臭氧O3的氧原子个数之比为______________