题目内容
(18分)已知可逆反应CO2(g) + H2(g) CO(g) + H2O(g),
CO(g) + H2O(g),
⑴写出该反应的化学平衡常数表达式:K= 。
⑵830K时,若起始时:c (CO2)=2mol/L,c (H2)=3mol/L,平衡时CO2的转化率为60%,氢气的转化率为 ;K值为 。
⑶830K时,若只将起始时c (H2)改为6mol/L,则氢气的转化率为 。
⑷若830K时,起始浓度c (CO2) =" a" mol/L,c (H2) =" b" mol/L,H2O的平衡浓度为c (H2O) =" c" mol/L,则:①a、b、c之间的关系式是 ;②当a = b时,a = c。
 CO(g) + H2O(g),
CO(g) + H2O(g),⑴写出该反应的化学平衡常数表达式:K= 。
⑵830K时,若起始时:c (CO2)=2mol/L,c (H2)=3mol/L,平衡时CO2的转化率为60%,氢气的转化率为 ;K值为 。
⑶830K时,若只将起始时c (H2)改为6mol/L,则氢气的转化率为 。
⑷若830K时,起始浓度c (CO2) =" a" mol/L,c (H2) =" b" mol/L,H2O的平衡浓度为c (H2O) =" c" mol/L,则:①a、b、c之间的关系式是 ;②当a = b时,a = c。
⑴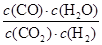 (3分) ⑵40%(3分), 1(3分) ⑶25%(3分)
(3分) ⑵40%(3分), 1(3分) ⑶25%(3分)
①c2=(a-c) (b-c) (3分) ② a=2c(3分)
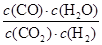 (3分) ⑵40%(3分), 1(3分) ⑶25%(3分)
(3分) ⑵40%(3分), 1(3分) ⑶25%(3分)①c2=(a-c) (b-c) (3分) ② a=2c(3分)
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据CO2(g) + H2(g)
 CO(g) + H2O(g)可知,该反应的平衡常数表达式为:K═
CO(g) + H2O(g)可知,该反应的平衡常数表达式为:K═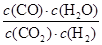 。
。(2)平衡时CO2的转化率为60%,则消耗CO2的浓度是2mol/L×0.6=1.2mol/L,所以根据反应式CO2(g) + H2(g)
 CO(g) + H2O(g)可知消耗氢气的浓度是1.2mol/L,所以氢气的转化率为
CO(g) + H2O(g)可知消耗氢气的浓度是1.2mol/L,所以氢气的转化率为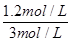 ×100%=40%。平衡时剩余CO2和氢气的浓度分别是0.8mol/L、1.8mol/L,生成CO和水蒸气的浓度均是1.2mol/L,所以该温度下反应的平衡常数K=
×100%=40%。平衡时剩余CO2和氢气的浓度分别是0.8mol/L、1.8mol/L,生成CO和水蒸气的浓度均是1.2mol/L,所以该温度下反应的平衡常数K=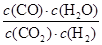 =
= =1。
=1。(3)830K时,若只将起始时c (H2)改为6mol/L,设消耗氢气的浓度为x,则
CO2(g) + H2(g)
 CO(g) + H2O(g)
CO(g) + H2O(g)起始浓度(mol/L) 2 6 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L) 2-x 6-x x x
所以根据平衡常数K可知
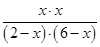 =1
=1解得x=1.5
所以氢气的转化率为
 ×100%=25%
×100%=25%(4)①若830K时,起始浓度c (CO2) =" a" mol/L,c (H2) =" b" mol/L,H2O的平衡浓度为c (H2O) =" c" mol/L,则
CO2(g) + H2(g)
 CO(g) + H2O(g)
CO(g) + H2O(g)起始浓度(mol/L) a b 0 0
转化浓度(mol/L) c c c c
平衡浓度(mol/L) a-c b-c c c
所以根据平衡常数K可知
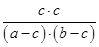 =1
=1解得c2=(a-c) (b-c)
②当当a=b时,则根据c2=(a-c) (b-c)可知a=2c。

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
 N2O4△H=—56.9kJ/mol下列分析不正确的是
N2O4△H=—56.9kJ/mol下列分析不正确的是
 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。 2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表: 2SO3的说法中正确的是
2SO3的说法中正确的是 CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
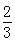 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )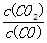
 2C(g)+ D(g);ΔH<0,在一定温度和压强下达到平衡。若平衡时C的物质的量与加入B的物质的量的变化关系如图所示。 则下列说法中正确的是
2C(g)+ D(g);ΔH<0,在一定温度和压强下达到平衡。若平衡时C的物质的量与加入B的物质的量的变化关系如图所示。 则下列说法中正确的是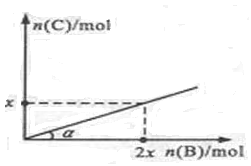
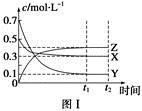
 2Z(g) ΔH>0
2Z(g) ΔH>0