题目内容
15.能源在国民经济中具有特别重要的战略地位.有人说能源相当于城市的血液,它驱动着城市的运转.(1)①丙烷常用作运动会火炬的燃料,图甲是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图(图中括号内“+”或“-”未标注),写出表示丙烷燃烧热的热化学方程式:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol.
②二甲醚(CH3OCH3)作为一种新型燃料,应用前景广阔.1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为1:3.
(2)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同.试运用盖斯定律回答下列问题:
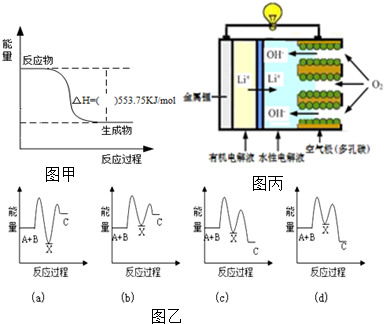
①反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0).如图乙示意图中,能正确表示总反应过程中能量变化的是d(填字母).
②已知:H2O(g)=H2O (l)△H1=-Q1kJ/mol
C2H5OH(g)=C2H5OH (l)△H2=-Q2kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为0.5Q3-0.5Q2+1.5Q1.
(3)水溶液锂电池体系,是复旦大学教授吴宇平课题组的一项重磅研究成果.研究成果刊发于2013年《自然》(Nature)杂志子刊《科学报道》(Sci.Report).如图丙某锂电池中用有机电解液将电极锂与水性电解液隔开的目的防止金属锂与水发生反应,其充电时阳极的电极反应式为4OH--4e-=O2↑+2H2O.
分析 (1)①分析图象得到生成1mol水的焓变△H=-553.75KJ/mol;依据热化学方程式书写方法写出,注意物质聚集状态,对应量下的焓变;
②依据热化学方程式结合混合气体物质的量和放热列式计算得到二甲醚和丙烷物质的量之比;
(2)①根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热,以此解答该题;
②依据热化学方程式,结合盖斯定律计算得到热化学方程式;
(3)防上锂与水发生氧化还原反应;阳极发生氧化反应,电极反应式为:4OH--4 e-=O2↑+2H2O.
解答 解:(1)①图象是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热△H=-553.75KJ/mol,则写出的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol,故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol;
②1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,设1mol混合气体中二甲醚物质的量x,丙烷物质的量为1-x,C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol,得到丙烷燃烧放热(1-x)2215KJ;依据条件得到:1645KJ-1455xKJ=(1-x)2215KJ,计算得到x=0.75,则混合丙烷物质的量为0.25mol,则混合气体中丙烷和二甲醚物质的量之比=0.25:0.75=1:3,故答案为:1:3;
(2)①由反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)可以看出,A+B→C(△H<0)是放热反应,A和B的能量之和大于C,由①A+B→X (△H>0)可知这步反应是吸热反应,X→C(△H<0)是放热反应,故X的能量大于A+B;A+B的能量大于C;X 的能量大于C,图象d符合,
故答案为:d:
②依据盖斯定律计算;
①C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H1=-Q3 kJ/mol,
②C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ/mol,
③H2O(g)=H2O(l);△H3=-Q1 kJ/mol.
依据盖斯定律:①-②+3×③得到:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H1=-(Q3-Q2+3Q1)kJ/mol,
若使23g液态无水酒精物质的量为0.5mol,完全燃烧,并恢复到室温,则整个过程中放出的热量为(0.5Q3-0.5Q2+1.5Q1 )KJ;
故答案为:0.5Q3-0.5Q2+1.5Q1;
(3)防上锂与水发生氧化还原反应;阳极发生氧化反应,电极反应式为:4OH--4 e-=O2↑+2H2O,故答案为:防止金属锂与水发生反应;4OH--4 e-=O2↑+2H2O.
点评 本题考查了燃烧热概念,热化学方程式的计算,盖斯定律的计算应用,物质的能量分析应用和化学反应的能量变化,热化学方程式的计算和盖斯定律的计算应用是解题关键,题目难度中等.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案| A. | 活泼性不同的两极 | B. | 闭合回路 | ||
| C. | 电源 | D. | 电解质溶液 |

(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2 (g)+CO (g)═CO2 (g)+NO (g)△H=-234 kJ•mol-1.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应热化学方程式如下:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知③H2O(g)═H2O(l)△H=-44kJ•mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为CH3OH (g)+$\frac{3}{2}$O2 (g)═CO2 (g)+2 H2O (l)△H=-764.7 kJ•mol-1.
(3)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
| A. | 酒精、CH3OH、有机物 | B. | 硝酸钠、NaNO3、盐 | ||
| C. | 氧化铁、Fe3O4、氧化物 | D. | 纯碱,NaOH、碱 |

 下列各种说法或表述正确的是⑤⑥.
下列各种说法或表述正确的是⑤⑥. 用如图装置进行实验,将A逐滴加入B中.
用如图装置进行实验,将A逐滴加入B中.