题目内容
(7分)(1)在配合物Fe(SCN)2+中提供空轨道接受孤电子对的微粒是 (填符号),画出配合物离子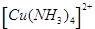 中的配位键 。
中的配位键 。
(2)根据价层电子对互斥理论,H30+中VSEPR模型名称为 ,BCl3分子的立体结构为 。
(3)按要求写出由第二周期元素为中心原子,通过SP3杂化形成中性分子的化学式(各写一种):正四面体分子 ,三角锥形分子 ,V型分子 。
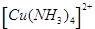 中的配位键 。
中的配位键 。(2)根据价层电子对互斥理论,H30+中VSEPR模型名称为 ,BCl3分子的立体结构为 。
(3)按要求写出由第二周期元素为中心原子,通过SP3杂化形成中性分子的化学式(各写一种):正四面体分子 ,三角锥形分子 ,V型分子 。
(7分)(1) Fe3+ 1分 ,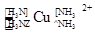 1分。
1分。
(2)正四面体 1分,正三角形(平面三角形)1分。
(3)CH4或CF4 1分, NH3或NF3 1分, H2O 1分
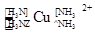 1分。
1分。(2)正四面体 1分,正三角形(平面三角形)1分。
(3)CH4或CF4 1分, NH3或NF3 1分, H2O 1分
(1)提供空轨道接受孤电子对的微粒是Fe3+。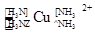
(2) H30+中VSEPR模型名称为正四面体,BCl3分子的立体结构为正三角形
(3)举例:正四面体分子:CH4, 三角锥形分子NH3, V型分子:H2O
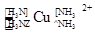
(2) H30+中VSEPR模型名称为正四面体,BCl3分子的立体结构为正三角形
(3)举例:正四面体分子:CH4, 三角锥形分子NH3, V型分子:H2O

练习册系列答案
相关题目
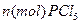 与
与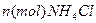 发生完全反应,释放出
发生完全反应,释放出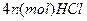 ,同时得到一种白色晶体A,A的熔点为113℃,在减压
,同时得到一种白色晶体A,A的熔点为113℃,在减压 时,50℃即可升华,测得A蒸气的密度(标准状况)为
时,50℃即可升华,测得A蒸气的密度(标准状况)为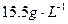 。
。