题目内容
【题目】某同学用0.2000mol/L的NaOH溶液滴定25.00mL某未知浓度的盐酸(指示剂为酚酞),滴定结果如下:
第一次 | 第二次 | |
NaOH起始读数 | 0.10mL | 0.30mL |
NaOH终点读数 | 18.60mL | 18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为__________mol/L。
(2)达到滴定终点的标志是___________。
(3)该同学的实验操作如下:
A.用酸式滴定管移取25.00mL的稀盐酸于锥形瓶中,滴加几滴酚酞试液;
B.用待测的稀盐酸润洗酸式滴定管;
C.检查滴定管是否漏水;
D.用蒸馏水洗干净滴定管;
E.另取锥形瓶,重复操作一次;
F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管至“0”刻度以上2cm,再把碱式滴定管固定好,调节液面至“0”刻度以下;
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶至滴定终点,记下滴定管液面所在刻度。
滴定操作的正确顺序是(用序号表示):C;_____;_____;A;C;D;F;G;E。
(4)实验操作G中在锥形瓶下垫一张白纸的作用_____________________。
【答案】0.1448 无色变粉红色且30s不变色 D B 便于观察滴定终点时锥形瓶内溶液颜色的变化
【解析】
(1)计算两次实验消耗NaOH溶液的平均体积,然后根据HCl~NaOH求盐酸的物质的量浓度;
(2)NaOH溶液滴定盐酸,以酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色且30s不变色;
(3)根据酸碱中和滴定操作判断顺序;
(4)根据操作对c(待测)=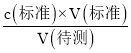 的影响进行分析滴定误差。
的影响进行分析滴定误差。
(1)二次消耗的NaOH溶液的体积分别为:18.50mL,17.70mL,两次消耗盐酸溶液的平均体积为18.10mL,根据酸碱中和反应HCl+NaOH=NaCl+H2O可知 HCl~NaOH,n(HCl)=n(NaOH),则c(HCl) ×25.00mL=0.20mol/L×18.10mL,解得:c(HCl) =0.1448mol/L;
(2)NaOH溶液滴定盐酸,以酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色且30s不变色,说明反应达到滴定终点;
(3)进行酸、碱中和滴定,首先应该检查滴定管是否漏水,然后用蒸馏水洗干净滴定管,用待测的稀盐酸润洗酸式滴定管;再用酸式滴定管移取25.00mL的稀盐酸于锥形瓶中,滴加几滴酚酞试液;检查滴定管是否漏水,然后用蒸馏水洗干净滴定管,取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管至“0”刻度以上2cm,再把碱式滴定管固定好,调节液面至“0”刻度以下;最后把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶至滴定终点,记下滴定管液面所在刻度。为减小实验误差,再另取锥形瓶,重复操作一次,故合理操作顺序为C、D、B、A、C、D、F、G、E。
(4)根据c(待测)=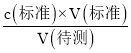 进行误差分析,实验操作G中在锥形瓶下垫一张白纸的作用就是便于观察滴定终点时锥形瓶内溶液颜色的变化,减小因滴定终点判断失误引起的误差,使实验测定值更接近真实值。
进行误差分析,实验操作G中在锥形瓶下垫一张白纸的作用就是便于观察滴定终点时锥形瓶内溶液颜色的变化,减小因滴定终点判断失误引起的误差,使实验测定值更接近真实值。


