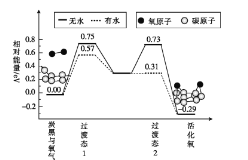
题目内容
【题目】含铬(+6价)废水严重危害人体健康,工业上常用还原法进行处理。其部分工艺流程如下:

(1)废水中,六价铬以CrO42-;或者Cr2O72-的形式存在,写出其相互转化的离子方程式______。我国常用NaHSO3做还原剂,写出还原池中反应的离子方程式__________。
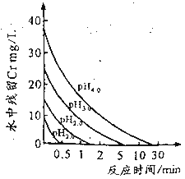
(2)废水中残留六价铬的浓度随溶液pH变化如图所示。实际生产中需控制pH=2.5~3.0,原因可能是_____________。
(3)沉淀池中生成Cr(OH)3的颗粒太细,为促使其更好地沉淀,可采取的措施是________。
(4)我国规定,工业废水中含Cr(VI)量的排放标准为0.1 mg/L。已知:Cr的相对原子质量为52,Kap(BaCrO4)=1.2×10-10。若用Ba2+除去废水中的CrO42-,达到废水排放标准时,废水中Ba2+浓度最低为___________mol/L(保留小数点后2位)。用Ba2+除去废水中的CrO42-是否可行,为什么?请简要回答。________________
【答案】2CrO42-+2H+![]() Cr2O72-+H2O 3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O 溶液中pH越高,废水中六价铬残留越多;溶液中pH越低,会腐蚀设备管道 加入絮凝剂 6.24×10-5 mol/L 不可行,因为废水中含有Ba2+,同样有毒
Cr2O72-+H2O 3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O 溶液中pH越高,废水中六价铬残留越多;溶液中pH越低,会腐蚀设备管道 加入絮凝剂 6.24×10-5 mol/L 不可行,因为废水中含有Ba2+,同样有毒
【解析】
(1)由工艺流程可知,加酸可以使CrO42-转化为Cr2O72-,还原池中,Cr2O72-在酸性条件下将HSO3—氧化生成SO42-,本身被还原为Cr3+;
(2)由图可知,溶液中pH越大废水中残留六价铬的浓度越大,而溶液中pH越小,酸性越强,可能会腐蚀设备管道;
(3)沉淀池中生成Cr(OH)3的颗粒太细,可向沉淀池中加入絮凝剂;
(4)由溶度积计算可得;Ba2+在溶液中有毒。
(1)由工艺流程可知,加酸可以使CrO42-转化为Cr2O72-,转化的离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O;还原池中,Cr2O72-在酸性条件下将HSO3—氧化生成SO42-,本身被还原为Cr3+,反应的离子方程式为3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O,故答案为:2CrO42-+2H+
Cr2O72-+H2O;还原池中,Cr2O72-在酸性条件下将HSO3—氧化生成SO42-,本身被还原为Cr3+,反应的离子方程式为3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O,故答案为:2CrO42-+2H+![]() Cr2O72-+H2O;3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O;
Cr2O72-+H2O;3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O;
(2)由图可知,溶液中pH越大废水中残留六价铬的浓度越大,而溶液中pH越小,酸性越强,可能会腐蚀设备管道,所以实际生产中需控制pH=2.5~3.0,故答案为:溶液中pH越高,废水中六价铬残留越多;溶液中pH越低,会腐蚀设备管道;
(3)沉淀池中生成Cr(OH)3的颗粒太细,可向沉淀池中加入絮凝剂,使Cr(OH)3更好地沉淀,故答案为:加入絮凝剂;
(4)达到废水排放标准时,CrO42-的浓度为![]() =
=![]() mol/L,则溶液中Ba2+浓度为
mol/L,则溶液中Ba2+浓度为![]() =
=![]() =6.24×10-5 mol/L;Ba2+在溶液中有毒,则用Ba2+除去废水中的CrO42-是不可行的,故答案为:6.24×10-5 mol/L;不可行,因为废水中含有Ba2+,同样有毒。
=6.24×10-5 mol/L;Ba2+在溶液中有毒,则用Ba2+除去废水中的CrO42-是不可行的,故答案为:6.24×10-5 mol/L;不可行,因为废水中含有Ba2+,同样有毒。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量 FeS和 SiO2)中回收铍和铜两种金属的工艺流程如图:
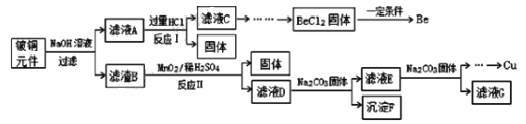
已知:
Ⅰ.铍、铝元素化学性质相似;
Ⅱ.常温下部分难溶物的溶度积常数如表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
Ksp | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的成分除 NaOH、Na2BeO2外,还有________(填化学式),写出反应I中Na2BeO2,与过量盐酸反应的化学方程式:_________________。
(2)从滤液C 中提纯纯BeCl2,最合理的实验步骤顺序为_________(填字母)
a.加入过量的氨水 b.通入过量 CO2 c.加入过量NaOH溶液 d.加入适量HCl e.洗涤 f.过滤
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的离子方程式:__________。若用浓HNO3溶解金属硫化物,缺点是________(任写一条)
(4)滤液D中c(Cu2+)= 2.2 molL-1、c(Fe3+) = 8.0×10 -3molL-1、c(Mn2+)= 0.01molL-1,逐滴加入 Na2CO3溶液调节pH 可将其转变成氢氧化物依次分离,首先沉淀的是______ (填离子符号)。为使铜离子开始沉淀,常温下应调节溶液的pH____4。