题目内容
用0.20mol/L的NaOH溶液滴定100.0mL0.20mol/LHCl溶液时,滴定误差在±0.1%以内,反应完毕后溶液的pH变化范围是
| A.5~9 | B.4.0~10.0 | C.4.3~9.7 | D.以上都不正确 |
B
试题分析:(1)计量点前计量点前误差为+0.1%时,即滴入NaOH的体积为99.9mL,NaOH不足。
此时锥形瓶溶液中是中和生成的NaCl和剩余的HCl。所以只要计算该溶液的PH值即可。
剩余的n(HCl)=n(HCl总)-n(NaOH)=0.2*(100.00-99.9)*10^-3=2*10^-6(mol)
则PH(前)=lg[c(HCl)]=4。
(2)计量点后半滴,即加入NaOH的体积为100.1mL,NaOH过量,此时为NaCl和NaOH的混合溶液,所以计算时只需考虑NaOH即可。
n(NaOH过量)=n(NaOH总)-n(NaOH反应)=0.2*(100.1-100)*10^-3)=2*10^-5(mol)
此时溶液体积v=100.00+100.1=200.1mL=200.1*10^-3(L),
所以[OH-]=n(NaOH过量)/v="2*10^-5/(200.1*10^-3)=1/100.05" *10^-2(mol/L)
[H+]=10^-14/[OH-] PH(后)=-lg[H+]=10所以突跃范围为4~10。故选B。
点评:酸碱中和滴定突跃范围的计算实际上也是强酸、强碱互相混合的计算,其规律是
(3)酸I+碱II
完全中和:[H+] =" [OH-]" = 1
 mol/L
mol/L酸过量: [H+]=

碱过量:[OH-] =

滴定突跃范围指计量点前半滴和后半滴滴定剂所引起的锥形瓶中溶液PH值的变化范围。要控制误差为+/-0.1%时。由于计量点时酸碱恰好完全反应,也就是滴入NaOH的体积为100.00mL时达计量点,所以计量点前误差为+0.1%时,是指加入NaOH的体积为99.9mL,而计量点后误差为-0.1%时指加入NaOH的体积为100.1mL。因此计算滴定突跃范围,只要计算出计量点前、后半滴时锥形瓶中溶液的PH(前)和PH(后)即可。

练习册系列答案
相关题目
 KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )
KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )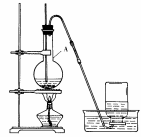
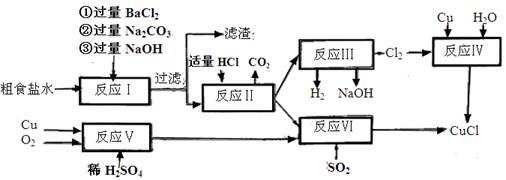
 。
。