题目内容
(11分)下图物质A~K均由a、b、c、d、e、f五种元素组成。a、b、c、d、e、f为原子序数依次增大的短周期元素;由a、b、c、d四种元素形成酸式盐A;b的最外层电子数是电子层数的2倍;由d、e元素可形成两种离子化合物,且阳离子与阴离子的个数比都为2 : 1,其中一种为X;B、C、D为常见的气体;F为白色胶状物质。(部分产物未列出)
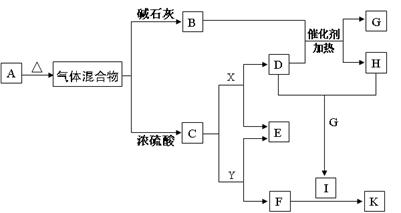
(1)物质A的化学式_______________
(2)Y的溶液呈 性(填“酸性” 、“碱性” 或“中性”),用离子反应方程式解释原因:
(3)将溶液K蒸干灼烧,得到的固体产物为 ,此固体产物的用途是 (答出一条即可)
(4)B与H在一定条件下反应生成c单质和G,反应中氧化产物与还原产物物质的量之比为
(5)常温下,向0.1mol/L的K溶液中加入Na2O2,加入Na2O2的质量与产生沉淀的质量具有如图所示关系
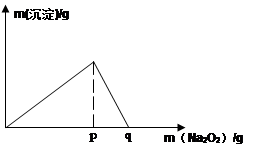
①当溶液pH= ,开始生成沉淀(已知生成沉淀的Ksp=1×10-31 )
②p点时产生沉淀与放出气体的物质的量之比为
③从开始加Na2O2固体至q点的整个过程中,总反应的离子方程式为 。

(1)物质A的化学式_______________
(2)Y的溶液呈 性(填“酸性” 、“碱性” 或“中性”),用离子反应方程式解释原因:
(3)将溶液K蒸干灼烧,得到的固体产物为 ,此固体产物的用途是 (答出一条即可)
(4)B与H在一定条件下反应生成c单质和G,反应中氧化产物与还原产物物质的量之比为
(5)常温下,向0.1mol/L的K溶液中加入Na2O2,加入Na2O2的质量与产生沉淀的质量具有如图所示关系
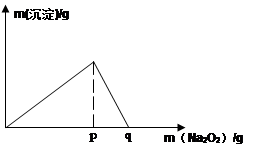
①当溶液pH= ,开始生成沉淀(已知生成沉淀的Ksp=1×10-31 )
②p点时产生沉淀与放出气体的物质的量之比为
③从开始加Na2O2固体至q点的整个过程中,总反应的离子方程式为 。
(1) NH4HCO3(1分)
(2)碱性(1分) AlO2-+2H2O Al(OH)3+OH-(1分)
Al(OH)3+OH-(1分)
(3)Al2O3 (1分) 高温耐火材料 (其他答案合理给分) (1分)
(4)2:3 (1分)
(5)①4 (1分) ②4:3 (2分) ③Al3++2Na2O2=AlO2-+O2↑+4Na+(2分)
(2)碱性(1分) AlO2-+2H2O
 Al(OH)3+OH-(1分)
Al(OH)3+OH-(1分)(3)Al2O3 (1分) 高温耐火材料 (其他答案合理给分) (1分)
(4)2:3 (1分)
(5)①4 (1分) ②4:3 (2分) ③Al3++2Na2O2=AlO2-+O2↑+4Na+(2分)
试题分析:b的最外层电子数是电子层数的2倍,则b可能为C
 和S
和S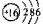 ,但a、b、c、d、e、f为原子序数依次增大的短周期元素,则b原子序数较小只能为C。d、e元素可形成两种离子化合物,且阳离子与阴离子的个数比都为2 : 1,则d只能是O元素,e只能是Na元素,X可能为Na2O2或Na2O。a、b、c、d四种元素形成酸式盐A,则A为NH4HCO3。NH4HCO3=NH3+H2O+CO2,则C为CO2,B为NH3。X为Na2O2,D为O2,G为H2O,H为NO,I为NO2。F为白色胶状物质,则F为Al(OH)3,则Y为NaAlO2,K为Al(NO3)3。
,但a、b、c、d、e、f为原子序数依次增大的短周期元素,则b原子序数较小只能为C。d、e元素可形成两种离子化合物,且阳离子与阴离子的个数比都为2 : 1,则d只能是O元素,e只能是Na元素,X可能为Na2O2或Na2O。a、b、c、d四种元素形成酸式盐A,则A为NH4HCO3。NH4HCO3=NH3+H2O+CO2,则C为CO2,B为NH3。X为Na2O2,D为O2,G为H2O,H为NO,I为NO2。F为白色胶状物质,则F为Al(OH)3,则Y为NaAlO2,K为Al(NO3)3。点评:关键是利用题干信息找到突破点,再依次根据推导的框图来求未知物。本题的突破点很多,比如说白色胶状物质应该是氢氧化铝,还有一些明显的信息可以直接推出未知物。

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
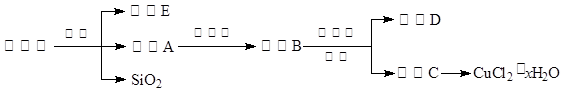



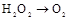
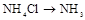
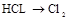
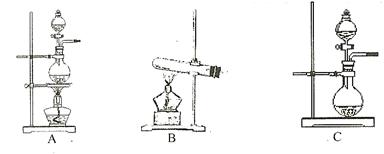
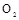 的装置制备
的装置制备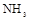 ,应选择的试剂为 .
,应选择的试剂为 .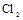 需用
需用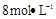 的盐酸1OOml,现用
的盐酸1OOml,现用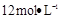 的盐酸来配制。
的盐酸来配制。