题目内容
有一包白色固体,可能含有Na+、K+、Ca2+、Cu2+、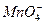 、Cl-、
、Cl-、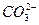 ,现做如下实验:
,现做如下实验:
①将少量固体放入水中,搅拌,静置,得无色溶液且底部有白色沉淀。
②过滤,向沉淀中加盐酸,沉淀全部溶解并产生气体。
③取少量滤液,加入AgNO3溶液有白色沉淀产生,再加稀HNO3,沉淀部分溶解并有气体放出。
请完成下列问题:
(1)白色固体中一定含有的离子是____________,一定没有的离子是_________________。
(2)白色固体中可能含有的离子是___________________,如检验其是否存在,还需进行的实验操作是_____________________________________________________________________。
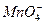 、Cl-、
、Cl-、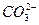 ,现做如下实验:
,现做如下实验:①将少量固体放入水中,搅拌,静置,得无色溶液且底部有白色沉淀。
②过滤,向沉淀中加盐酸,沉淀全部溶解并产生气体。
③取少量滤液,加入AgNO3溶液有白色沉淀产生,再加稀HNO3,沉淀部分溶解并有气体放出。
请完成下列问题:
(1)白色固体中一定含有的离子是____________,一定没有的离子是_________________。
(2)白色固体中可能含有的离子是___________________,如检验其是否存在,还需进行的实验操作是_____________________________________________________________________。
(1)Ca2+、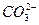 、Cl- Cu2+、
、Cl- Cu2+、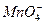
(2)Na+、K+ 焰色反应
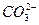 、Cl- Cu2+、
、Cl- Cu2+、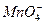
(2)Na+、K+ 焰色反应
①得无色溶液,说明不含有有色离子Cu2+、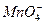 ;有白色沉淀生成,说明一定含有Ca2+和
;有白色沉淀生成,说明一定含有Ca2+和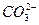 。
。
②加盐酸,沉淀全部溶解并产生气体,证实沉淀是CaCO3。
③滤液中加入AgNO3溶液有白色沉淀产生,加稀HNO3沉淀部分溶解说明一定含有Cl-和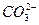 。
。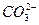 是因Ca2+较少而进入滤液的。至此,白色固体中一定含有Ca2+、Cl-、
是因Ca2+较少而进入滤液的。至此,白色固体中一定含有Ca2+、Cl-、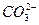 ,一定不含有Cu2+、
,一定不含有Cu2+、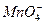 ,可能含有Na+、K+。
,可能含有Na+、K+。
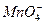 ;有白色沉淀生成,说明一定含有Ca2+和
;有白色沉淀生成,说明一定含有Ca2+和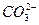 。
。②加盐酸,沉淀全部溶解并产生气体,证实沉淀是CaCO3。
③滤液中加入AgNO3溶液有白色沉淀产生,加稀HNO3沉淀部分溶解说明一定含有Cl-和
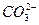 。
。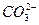 是因Ca2+较少而进入滤液的。至此,白色固体中一定含有Ca2+、Cl-、
是因Ca2+较少而进入滤液的。至此,白色固体中一定含有Ca2+、Cl-、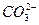 ,一定不含有Cu2+、
,一定不含有Cu2+、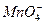 ,可能含有Na+、K+。
,可能含有Na+、K+。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目