��Ŀ����
����Ŀ��Ԫ��X��Y��Z��M��N��Ϊ����������Ԫ�أ���ԭ����������������֪Yԭ������������������������֮��Ϊ3��4��Mԭ�ӵ���������������������֮��Ϊ3��4��N����Arԭ�ӵ��Ӳ�ṹ��ͬ��X�Ƕ���������Ԫ����ԭ�Ӱ뾶��С�ģ�Z�Ƕ���������Ԫ����ԭ�Ӱ뾶���ģ�������XN������Ϊ���壮�ݴ˻ش�
��1��N������������Ӧˮ����Ļ�ѧʽ�� ��
��2��Z��M�γɵĻ�����ˮ��Һ�Լ��ԣ���ԭ�����������ӷ���ʽ��ʾ����
��3��X��Y��X��M�����γ�18���ӷ��ӣ������ַ�����ˮ��Һ�з�Ӧ�ɹ۲쵽�������� �� ��Ӧ�Ļ�ѧ����ʽ�� ��
��4����X��Y��Z��M����Ԫ�����һ��ǿ�����ʽ�Σ�д��Ba��OH��2��Һ����μ��������Һ�����Ե����ӷ���ʽ ��
��5��Y��Z��N�γɵĻ������ˮ��Һ������Ũ�ȵĴ�С˳���� ��
��6����ͼ��ʾ�� 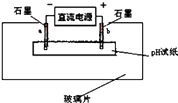
ȡһ����ZN��Һ��ʪ��pH��ֽƽ���ڲ���Ƭ�ϣ�ȡ����ʯī�����缫����ֱͨ����Դ��һ��ʱ���a�缫����pH��ֽ�Ͽɹ۲쵽�������� ��
���𰸡�
��1��HClO4
��2��S2��+H2O?HS��+OH��
��3����ɫ��Һ�в�������ɫ������H2O2+H2S=S��+2H2O
��4��Ba2++2OH��+2H++SO42��=BaSO4��+2H2O
��5��c��Na+����c��ClO������c��OH������c��H+��
��6����ֽ�ȱ����������ɫ�����������Ư����ɫ
���������⣺Yԭ������������������������֮��Ϊ3��4�������������������ܳ���8������Y������������ֻ����6��ԭ������Ϊ8����Y��O��Mԭ�ӵ����������������������֮����3��4��������Ԫ�صĴ���������һ����2��8������M��ԭ������Ӧ����16����M��S��X�Ƕ�����Ԫ����ԭ�Ӱ뾶��С��Ԫ�أ���X��H��Z�Ƕ�����Ԫ����ԭ�Ӱ뾶����Ԫ�أ���Z��Na��N��ԭ�������������X�γɵĻ�����XN�����������壬��N����Arԭ�ӵ��Ӳ�ṹ��ͬ������N��Cl����1���ȵ�����������ˮ����Ļ�ѧʽ�� HClO4 �� ���Դ��ǣ�HClO4����2��ZΪ�ƣ�MΪS��Z��M�γɵĻ�����Ϊ���ƣ�Ϊǿ�������Σ�ˮ��ʼ��ԣ����ӷ���ʽΪS2��+H2OHS��+OH�� �� ���Դ��ǣ�S2��+H2OHS��+OH������3��X��Y�γɵ�18���ӻ�����ΪH2O2 �� X��M�γɵ�18���ӻ�����ΪH2S�����߷�Ӧ�������ʵ���ɫ����������H2O2+H2S=S��+2H2O�����Դ��ǣ���ɫ��Һ�в�������ɫ������H2O2+H2S=S��+2H2O����4��Y��Z��N�γɵĻ�����Ϊ�������ƣ���Ba��OH��2��Һ����μ�������������Һ�����ԣ����߰�1��2��Ӧ�������ᱵ�������ơ�ˮ���������ʵ���Ϊ1��1��2����Ӧ�����ӷ���ʽΪ��Ba2++2OH��+2H++SO42��=BaSO4��+2H2O�����Դ��ǣ�Ba2++2OH��+2H++SO42��=BaSO4��+2H2O����5��Y��Z��N�γɵĻ�����ΪNaClO��Ϊǿ�������Σ�ˮ��ʼ��ԣ���Һ�д���c��Na+����c��ClO������c��OH������c��H+�������Դ��ǣ�c��Na+����c��ClO������c��OH������c��H+������6������Ȼ�����Һ��aΪ����������2H2O+2 e��=H2��+2OH�� �� ��Һ�ʼ��ԣ�pH����ɫ�����ŵ��Ľ��У���ɫ��Χ������������������������ˮ��Ӧ���ɾ���Ư���Ե�HClO����ʹ��ֽƯ����ɫ�����Դ��ǣ���ֽ�ȱ����������ɫ�����������Ư����ɫ��

 ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�