题目内容
(12分)2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1= -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2= -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3= -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
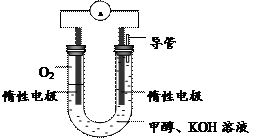 (3)某实验小组依据甲醇燃烧的反应原理,
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如右图所示的电池装置。该电池正极的电极反应为
。
② 工作一段时间后,测得溶液的pH减小,
该电池总反应的化学方程式为
。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应Ⅱ: CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2① 上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1= -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2= -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3= -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
 (3)某实验小组依据甲醇燃烧的反应原理,
(3)某实验小组依据甲醇燃烧的反应原理,①设计如右图所示的电池装置。该电池正极的电极反应为
。
② 工作一段时间后,测得溶液的pH减小,
该电池总反应的化学方程式为
。
(1)① I ② < ③ 80% 250℃
(2) CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol
(3)① O2 + 2H2O + 4e- =" " 4OH-
② 2CH3OH + 3O2 + 4OH- = 2CO32- + 6H2O
(2) CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol
(3)① O2 + 2H2O + 4e- =" " 4OH-
② 2CH3OH + 3O2 + 4OH- = 2CO32- + 6H2O
(1)①反应Ⅰ的产物只有甲醇,而反应Ⅱ的产物有两种,故反应Ⅰ符合“原子经济”原则;②观察图表数据可得,升温时,K值变小,说明该反应的正反应为放热反应,即ΔH1<0;③CO的转化率="[2" mol- 0.2 mol/L×2L]/2mol×100%= 80%;此时的化学平衡常数为K= c(CH3OH)/ c(CO)× c2(H2)="0.8" mol.L-1/0.2 mol.L-1×(1.4 mol.L-1)2=2.041,故此时的温度为250℃。
(2)将三个热化学方程式进行变形:①+[-②]+4×③,可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式,即CH3OH(l)+ O2(g) = CO(g) + 2H2O(l),ΔH=ΔH1+[-ΔH2]+4ΔH3=﹣442.8 kJ∕mol
(3)②先写出甲醇燃烧的反应式为2CH3OH + 3O2 = 2CO2 + 4H2O 、2CO2 + 4KOH=2K2CO3 + 2H2O,将以上两式进行合并,可得该电池的总反应式为 2CH3OH + 3O2 + 4OH- = 2CO32- + 6H2O 。
(2)将三个热化学方程式进行变形:①+[-②]+4×③,可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式,即CH3OH(l)+ O2(g) = CO(g) + 2H2O(l),ΔH=ΔH1+[-ΔH2]+4ΔH3=﹣442.8 kJ∕mol
(3)②先写出甲醇燃烧的反应式为2CH3OH + 3O2 = 2CO2 + 4H2O 、2CO2 + 4KOH=2K2CO3 + 2H2O,将以上两式进行合并,可得该电池的总反应式为 2CH3OH + 3O2 + 4OH- = 2CO32- + 6H2O 。

练习册系列答案
相关题目