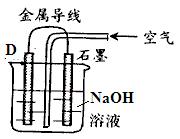
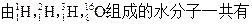题目内容
五种元短周期元素有关数据如表。其中的X是表示元素原子在分子内吸收电子能力的大小,X越大,原子吸引电子的能力越强,其最大值为4.0,最小值是0.7。试回答下列问题:
(1)X3的值应该为( )
A.3.6 B.3.1 C.2.5 D.1.4
(2)E元素在元素周期表中的位置是 ,B元素单质的电子式为 。
(3)A元素的原子中有 个未成对电子。A、B、C元素形成的单质中,结构微粒间作用力最强的是 (写物质名称)。
(4)用一个化学反应可以证明B和C非金属性的强弱,写出该反应的化学方程式:
。
用一个化学反应也可以证明D元素和与D元素同周期且原子半径最大的元素(非零族)的金属性的强弱,写出该反应的离子方程式:
。
| 元素编号 | A | B | C | D | E |
| X | 3.5 | 3.0 | X3 | 1.5 | 1.5 |
| 主要化合价 | -2 | +7 | +6 | +3 | +2 |
(1)X3的值应该为( )
A.3.6 B.3.1 C.2.5 D.1.4
(2)E元素在元素周期表中的位置是 ,B元素单质的电子式为 。
(3)A元素的原子中有 个未成对电子。A、B、C元素形成的单质中,结构微粒间作用力最强的是 (写物质名称)。
(4)用一个化学反应可以证明B和C非金属性的强弱,写出该反应的化学方程式:
。
用一个化学反应也可以证明D元素和与D元素同周期且原子半径最大的元素(非零族)的金属性的强弱,写出该反应的离子方程式:
。
(1)C
(2)第二周期IIA族

(3)2, 硫
(4)H2S+C12→2HC1+S A1(OH)3+OH—→A1O2—+2H2O
本题考查元素周期律。由题意可知,X越大,元素的非金属性越强,再根据化合价可以推出,A是氧元素,B是氯元素,C是硫元素,D是铝元素,E的X值与铝相同,说明两者的性质相似,所以E是铍元素。(1)X3介于3.0和1.5之间,选C;(2)铍元素在周期表中位置是第二周期IIA族,B的单质是氯气;(3)A、B、C元素形成的单质分别是氧气、氯气、硫,硫的相对分子质量最大,所以分子间作用力最强;(4)利用氧化还原反应中氧化剂的氧化性强于氧化产物;比较钠和铝性质强弱的一般方法是分别将金属单质与水反应,钠与水反应剧烈,但此处是用一个反应方程式来表示,则可以利用两种元素最高价氧化物的水合物的碱性强弱关系,即A1(OH)3是两性氢氧化物,能够与强碱NaOH反应,离子方程式为A1(OH)3+OH—→A1O2—+2H2O。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
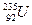 的说法正确的是( )
的说法正确的是( )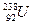 是两种不同的元素
是两种不同的元素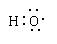 组成元素相同,含有相同的电子数
组成元素相同,含有相同的电子数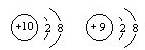 的两种粒子为同一种元素
的两种粒子为同一种元素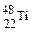 和
和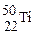 的说法中正确的是
的说法中正确的是  和
和